ARTÍCULO ORIGINAL
doi: http://dx.doi.org/10.7705/biomedica.v34i1.1535
1 Laboratorio de Control Motor Humano, Escuela de Kinesiología, Facultad de Ciencias de la Salud, Universidad de Talca, Talca, Chile
2 Escuela de Kinesiología, Facultad de Ciencias de la Salud, Universidad de Talca, Talca, Chile
3 Programa de Doctorado en Ciencias Médicas, Universidad de La Frontera, Temuco, Chile
Contribución de los autores:
Valeska Gatica: obtención del financiamiento, diseño del estudio, supervisión del análisis estadístico y redacción del manuscrito.
Sofía Velásquez: evaluación y recolección de los datos.
Guillermo Méndez: análisis de los datos y creación de las figuras.
Eduardo Guzmán: análisis estadístico.
Carlos Manterola: revisión crítica del manuscrito.
Recibido: 29/10/12; aceptado: 22/08/13
Introducción. La discapacidad física es la más frecuente (10,3 %) de las discapacidades en la zona central de Chile. La parálisis cerebral infantil es una de las patologías que genera déficit motor y pérdida del balance. El balance es crucial para la mantención de la estabilidad postural.
Objetivos. Establecer las diferencias en las variables de área y velocidad promedio del centro de presión entre niños con desarrollo típico y pacientes con parálisis cerebral, así como conocer el grado de utilización de los diferentes sistemas sensoriales.
Materiales y métodos. Se realizó un estudio transversal con una muestra por conveniencia dividida en dos grupos de estudio: desarrollo típico (n=7) y parálisis cerebral (n=7). Los parámetros obtenidos desde la plataforma de fuerza fueron área y velocidad promedio del centro de presión y las bandas de frecuencia (0,0625, 0,125, 0,25, 0,5, 1, 2 y 4 Hz).
Resultados. Durante la fase de vista al frente los pacientes con parálisis cerebral presentaron una velocidad promedio de centro de presión significativamente mayor que el grupo con desarrollo típico (p=0,043). Las bandas de frecuencias 0,25 Hz y 0,5 Hz relacionadas con el sistema vestibular presentaron diferencias significativas entre los grupos estudiados (p=0,021 y p=0,036). En la fase de ojos cerrados se observó un aumento significativo en el centro de presión y una mayor utilización del sistema vestibular otolítico en el grupo con parálisis.
Conclusiones. Los pacientes con parálisis cerebral presentaron un menor balance de pie, además de utilizar de manera significativa el sistema vestibular en ambas fases de la prueba.
Palabras clave: postura, balance postural, parálisis cerebral, actividad motora, vestíbulo del laberinto.
doi: http://dx.doi.org/10.7705/biomedica.v34i1.1535
Differences in standing balance in patients with cerebral palsy and typically developing children
Introduction: Physical disability is the most common disability (10.3 %) in the central area of Chile. The cerebral palsy is one of the diseases that generates motor deficits and loss of balance. Balance is crucial for maintaining postural stability.
Objective: To establish the differences in area and average velocity of the center of pressure between typically developing children and cerebral palsy patients, and to determine the degree of use of different sensory systems.
Materials and methods: This was a cross-sectional study. A convenience sample was divided into two groups: typically developing children (n=7) and cerebral palsy patients (n=7). The parameters measured by a force plate were the area and average velocity of excursion of the center of pressure, as well as the frequency bands ( 0.0625, 0.125, 0.25, 0.5, 1, 2 and 4 Hz) .
Results: During the eyes open condition, the cerebral palsy subject had an average velocity of the center of pressure significantly higher than the typically developing children group (p=0.043). The frequency bands 0.25 Hz and 0.5 Hz related to the vestibular system showed significant differences between groups (p=0.021 y p=0.036). In the eyes closed phase a significant increase in the area of the center of pressure and a higher use of the otolithic vestibular system were observed in the cerebral palsy group.
Conclusions: Cerebral palsy patients showed a lower standing balance in addition to using the vestibular system significantly more both in eyes open and eyes closed phases.
Keywords: Posture, postural balance, cerebral palsy, motor activity, vestibule, labyrinth.
doi: http://dx.doi.org/10.7705/biomedica.v34i1.1535
La parálisis cerebral se describe como un grupo de trastornos permanentes del desarrollo del movimiento y la postura que causa limitaciones en la actividad diaria atribuidas a alteraciones no progresivas que ocurren durante el desarrollo fetal o infantil del cerebro (1). La parálisis cerebral se considera la principal causa de discapacidad física durante la infancia (2). Este tipo de pacientes comúnmente presenta problemas en la marcha y no logra realizar los movimientos de manera adecuada (3,4). En este sentido, uno de los factores que se ha identificado es el deterioro del balance, dado que mantener la estabilidad postural es crucial para todos los movimientos (3). Diversas investigaciones indican, además, que el deterioro del balance se correlaciona con las limitaciones funcionales en niños con parálisis cerebral (5,6).
Los sistemas de control postural son responsables de mantener el balance. Éstos incluyen el sistema sensorial, el cual recibe los estímulos visuales, vestibulares y mecanorreceptores que provienen del ambiente. El sistema nervioso central, el cual también forma parte de los sistemas de control postural, lleva la información integrada desde el sistema sensorial hacia el sistema motor. Este, finalmente, es el encargado de realizar la activación y los ajustes necesarios a nivel neuromuscular, permitiendo un balance adecuado a las exigencias del ambiente (7,8).
La plataforma de fuerza es la herramienta principal de cuantificación del balance en el mundo (3,4). La persona permanece de pie sobre esta estructura mientras dura la prueba. La plataforma de fuerza es un equipo de laboratorio que permite registrar el punto o localización del vector vertical de la fuerza de reacción del suelo generado por el cuerpo al estar de pie o en movimiento, en otras palabras, en la plataforma se mide el centro de presión (8, 9). De esta forma, el equipo detecta los momentos y las fuerzas para así obtener el centro de presión. Las variables contempladas en un análisis global, las cuales se obtienen del centro de presión, son variadas, siendo el área, la velocidad promedio y la variabilidad de la oscilación las más utilizadas (9,10). De estas, la velocidad promedio se ha considerada como la medida más confiable utilizada en las investigaciones clínicas (11). Otras variables que se pueden obtener son el componente en el eje medio-lateral y antero- posterior de la velocidad y variabilidad del centro de presión, así como las bandas de frecuencia.
Diversas investigaciones han demostrado que los niños estadounidenses con parálisis cerebral tardan más tiempo en recuperar la estabilidad postural y muestran más desplazamiento del centro de presión durante la fase previa de alcanzar la estabilidad que los niños de la misma edad con desarrollo motor típico (3,4). Sin embargo, no existen reportes del comportamiento del centro de presión en pacientes con parálisis cerebral en el continente suramericano.
Por otra parte, la información científica respecto a la maduración de los sistemas sensoriales y su aporte al balance de pie es amplia, y en algunos puntos difiere. Por ejemplo, Hirabayashi e Iwasaki encontraron que el balance óptimo de pie se alcanza a la edad de 15 años, mientras que Shumway-Cook y Woollacott señalaron que los niños de 7 a 10 años participantes en su estudio eran capaces de resolver conflictos intersensoriales de manera similar a los adultos (12,13).
Más tarde, Steindl y colaboradores evaluaron el balance de pie en 140 niños y 20 adultos (14) con el objetivo de investigar el desarrollo de la organización sensorial de acuerdo con los componentes visual, vestibular y propioceptivo. Para ello, dividieron al grupo de participantes jóvenes en siete subgrupos: 3 a 4 años, 5 a 6 años, 7 a 8 años, 9 a 10 años, 11 a 12 años, 13 a 14 años y 15 a 16 años. Los adultos, considerados como grupo de referencia, tenían un rango de edad de 17 a 49 años. La prueba de balance se realizó de la siguiente forma: una fase de vista al frente, una con ojos cerrados y otra con oscilación en la base de la plataforma con la mirada siguiendo un blanco visual; cada una de estas fases se realizó sobre una plataforma de fuerza estática y dinámica para un total de seis condiciones de evaluación. Bajo estas condiciones de estudio, la función propioceptiva se observó madura a la edad de 3 a 4 años. En cambio el comportamiento del sistema visual y vestibular alcanzó niveles similares al de los adultos a la edad de 15 a 16 años (14). Los resultados de esta investigación son semejantes a los encontrados por Hirabayashi e Iwasaki (12). Sin embargo, no existen antece- dentes al respecto en América Latina en personas con desarrollo típico y, mucho menos, en pacientes con parálisis cerebral.
Teniendo en cuenta lo anterior, el objetivo de esta investigación fue establecer las diferencias en las variables de área y velocidad promedio del centro de presión entre niños con desarrollo típico y pacientes con parálisis cerebral, así como conocer el grado de utilización de los diferentes sistemas sensoriales (visual, vestibular y somatosensorial, incluidos mecanorreceptores y propioceptores) durante la evaluación del balance de pie en estos grupos de estudio.
Materiales y métodos
Diseño
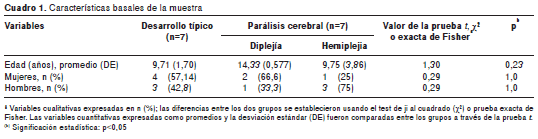
Se hizo un estudio de corte transversal con un muestreo no probabilístico por conveniencia. El grupo de participantes con parálisis cerebral provino de un centro de rehabilitación neurológico. El grupo con desarrollo típico pertenecía a una escuela pública urbana. Ambas poblaciones son parte de la zona central de Chile, específicamente de la región del Maule. La muestra total fue de 14 voluntarios, siete pacientes con parálisis cerebral (1 hombre y 2 mujeres con diplejía espástica; 3 hombres y 1 mujer con hemiplejia espástica) y siete con desarrollo típico (3 hombres y 4 mujeres).
Criterios de selección de la muestra
Para el análisis del balance fueron incluidos voluntarios de 6 a 15 años de ambos sexos en cada grupo de estudio. Los participantes del grupo con parálisis cerebral presentaban un diagnóstico topográfico de diplejía o hemiplejía espástica con un compromiso funcional nivel I o II según el Sistema de Clasificación de la Función Motora Gruesa ( Gross Motor Function Classification System, GMFCS) (15-17). Con este compromiso motor, los individuos presentaban una deambulación sin restricciones o con una mínima asistencia. Cada participante debía ser capaz de estar de pie durante 30 segundos, tiempo de duración de cada fase de evaluación del balance. Fueron excluidos los participantes con impedimento cognitivo moderado o grave e impedimentos asociados (alteraciones visuales no corregidas y alteraciones vestibulares) (18). Los participantes del grupo de desarrollo típico eran voluntarios sin las características clínicas anteriormente descritas.
A los tutores o apoderados se les explicó claramente en qué consistía la evaluación; se discutió con ellos el consentimiento informado y se obtuvo el asentimiento de los voluntarios. Ambos documentos fueron aprobados por el Comité de Bioética de la Universidad de Talca.
Procedimientos
Las evaluaciones se llevaron a cabo en el centro de rehabilitación neurológico y en la escuela pública sin alterar las circunstancias de sus actividades habituales. Las mediciones del grupo con parálisis cerebral se hicieron durante la tarde a partir de las 14:00 y hasta las 17:00. En cambio las mediciones del grupo de personas con desarrollo típico se realizaron en la mañana, desde las 09:00 hasta las 11:00. Al inicio de cada evaluación los participantes o apoderados fueron consultados por un profesional de la salud, quien constató las respectivas historias clínicas.
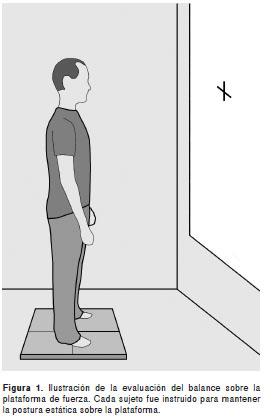
El balance de pie se evaluó empleando una plataforma de fuerza posturográfica. Para la prueba se solicitó a cada participante que se ubicara de pie sobre la plataforma en posición relajada y con los brazos a cada lado del tronco. La evaluación del balance se hizo en dos fases: una fase de vista al frente en la que el participante fijaba su mirada en un blanco (cruz de color negro) ubicado en la pared a una distancia de 1,5 m, en tanto que la otra fase se realizó con los ojos cerrados (figura 1). Cada fase se repitió tres veces de manera alternada en cada uno de los voluntarios, escogiendo al azar una de ellas para el análisis.

Una vez realizada la evaluación, los datos se obtuvieron a partir de una señal análoga desde la plataforma, la cual se convirtió en imagen digital por medio de un convertidor análogo digital de 16 bits y una frecuencia de muestreo de 40 Hz. Los datos se transfirieron finalmente a un computador convencional en el cual se obtuvieron las variables del centro de presión utilizando el software Igor Pro, versión 5,01.
Definición de las variables
Las siguientes fueron las variables resultantes analizadas en cada grupo de estudio a partir de la excursión del centro de presión: área, velocidad promedio del desplazamiento y bandas de frecuencia. Las bandas de frecuencia se obtuvieron a partir de una transformada matemática llamada de ondícula ( wavelet ), y tuvieron los siguientes valores: 0,0625, 0,125, 0,25, 0,5, 1, 2 y 4 Hz. Estos parámetros se relacionan con los sistemas sensoriales encargados del balance postural. La banda de frecuencia de 0,0625 Hz se relaciona con el sistema visual y vestibular otolítico; la de 0,125 Hz y la de 0,25 Hz, con el sistema vestibular otolítico; la de 0,5 Hz y la de 1 Hz, con los canales semicirculares y la de 2 Hz y la de 4 Hz, con el sistema somatosensorial, el cual incluye a mecanorreceptores cutáneos y propioceptores que se activan en la posición de pie (19,20).
Análisis estadístico
Los datos fueron analizados con el software SPSS 14.0 (Inc., 233 South Wacker Drive, Chicago, IL 60606-6412, USA) para Windows. Se utilizó estadística inferencial para el análisis de los parámetros del centro de presión. Para el análisis de las diferencias de los promedios se realizó la prueba t, además de la prueba de Levene para verificar la homogeneidad de varianza. Se consideró significativo un valor de p<0,05.
Resultados
Los grupos estudiados eran homogéneos en cuanto a edad, sexo y número (cuadro 1). La totalidad de los participantes mantuvo el balance de pie durante el tiempo que requirió la prueba. El supuesto de normalidad fue probado a partir del test Shapiro-Wilks en las variables estudiadas, permitiendo la aplicación de la prueba t para muestras independientes.
Entre los pacientes con diplejía y hemiplejia espástica del grupo con parálisis cerebral no hubo diferencias significativas en las variables estudiadas (área y velocidad del centro de presión y bandas de frecuencias). En la figura 2 (A, B, C y D) se muestran dos ejemplos del trazado del centro de presión tomados de un voluntario con hemiplejia y otro con diplejía.

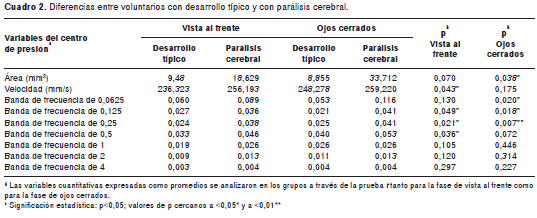
Los cálculos y diferencias del balance de pie entre los grupos (desarrollo típico y parálisis cerebral) se presentan en el cuadro 2.
Balance durante la fase de vista al frente
No hubo diferencias significativas en la variable de área del desplazamiento del centro de presión entre los grupos estudiados. En cambio, la velocidad promedio del centro de presión presentó un aumento significativo (p=0,043) en los pacientes con parálisis cerebral comparado con el grupo de desarrollo típico. En la figura 2 (A, C y E) se muestran ejemplos del trazado del centro de presión tomados de los voluntarios de ambos grupos.
Las bandas de frecuencias relacionadas con el sistema vestibular otolítico (0,25 Hz) y con el de los canales semicirculares (0,5 Hz) presentaron diferencias significativas entre los grupos estudiados (p=0,021 y p=0,036). Sin embargo, la banda 0,125 mostró una significación muy cercana al valor de p (cuadro 2).
Balance durante la fase de ojos cerrados
Los pacientes con parálisis cerebral registraron un aumento significativo en el área de desplazamiento del centro de presión con respecto al grupo con desarrollo típico. En cambio, la velocidad del centro de presión no mostró diferencias significativas entre los grupos estudiados. En la figura 2 (B, D y F) se muestran las diferencias en el trazado del centro de presión entre los grupos de estudio.
Las bandas de frecuencia relacionadas con el sistema vestibular otolítico (0,0625, 0,125 y 0,25) mostraron diferencias significativas entre los grupos de estudio (cuadro 2).
Discusión
Los pacientes con parálisis cerebral evaluados en el estudio presentaron valores mayores en las variables de velocidad promedio durante la fase de vista al frente y de área del centro de presión en la fase de ojos cerrados con respecto al grupo de desarrollo típico. Sin embargo, en nuestra investigación no se registraron diferencias significativas en las variables de área del centro de presión en fase de vista al frente y de velocidad promedio del centro de presión en la fase de ojos cerrados. Entre las causas posibles está el hecho de haber aplicado las evaluaciones del balance en condiciones dinámicas o bien la necesidad de un mayor tamaño de la muestra. En este estudio y en otras diversas investigaciones se ha hecho énfasis en que los participantes con déficit neurológico sean similares en cuanto a sus características clínicas, pues estas juegan un papel relevante en la clasificación de la función motora y cognitiva (3,4,21). Este aspecto en cierta forma incidió en el reducido tamaño de la muestra, ya que en los centros de rehabilitación neurológica hay pacientes con diversos y amplios compromisos motores, cognitivos o asociados.
Durante la fase de vista al frente la velocidad promedio del centro de presión fue significativamente mayor en el grupo con parálisis cerebral, lo que evidenció una mayor oscilación postural en este grupo. Esta mayor oscilación del centro de presión afectó desfavorablemente la variable de área, generando una tendencia al aumento. Los valores registrados en esta variable, si bien fueron el doble en los pacientes con parálisis cerebral, no fueron significativos (cuadro 2). Estos hallazgos son coincidentes con los de otras investigaciones. Por ejemplo, Donker , et al., demostraron la presencia de una mayor amplitud de oscilación en personas con parálisis cerebral que en sujetos con desarrollo normal (21). Ambos grupos estaban compuestos por nueve participantes, cada uno con un rango de edad entre 5 y 11 años. Es interesante anotar que estos autores observaron mayores valores en la oscilación promedio del centro de presión en los participantes con parálisis cerebral, aunque se expresaron sólo como tendencias (p=0,062) (21).
Diversos autores han demostrado que existe una estrecha relación entre la edad y la madurez fisiológica de los componentes sensoriales (12,14,22). Se ha establecido que al finalizar la adolescencia, los estímulos que viajan por las aferencias visuales y vestibulares alcanzan los niveles más altos en el sistema nervioso central, logrando la integración de la información periférica y, consecuentemente, los ajustes posturales de manera similar a los adultos (14). Desde esta perspectiva y teniendo en cuenta la edad promedio, en esta investigación ambos grupos presentaron un grado de inmadurez en las aferencias visuales y vestibulares (grupo con desarrollo típico, 9,71 años y grupo con parálisis cerebral, 11,71 años de edad). Sin embargo, el grupo con parálisis cerebral presentó una dependencia significativa del sistema vestibular otolítico (banda de frecuencia de 0,25 Hz) y de los canales semicirculares (banda de frecuencia de 0,5 Hz) comparado con el grupo de referencia. Nuestra hipótesis es que el daño cerebral sufrido en la infancia, causante de la condición de discapacidad física, contribuiría al mayor requeri- miento del sistema vestibular observado.
Durante la evaluación del balance de pie en ausencia del sistema visual, el área de desplazamiento del centro de presión fue significativamente mayor en el grupo con parálisis cerebral que en el grupo de referencia. Este aumento del área del centro de presión da cuenta del mayor grado de inestabilidad de los pacientes con parálisis cerebral en la posición de pie. La literatura señala que mantener el balance durante la condición de ojos cerrados se considera una prueba exigente en la que los sistemas vestibular y somatosensorial se ven altamente requeridos por el sistema nervioso central para mantener el control postural (23). En este estudio los participantes con parálisis cerebral mostraron una gran dependencia del sistema vestibular otolítico (bandas de 0,0625, 0,125 y 0,25 Hz) y de los canales semicirculares (banda de 0,5 Hz) comparados con el grupo de desarrollo típico. Si bien los pacientes con parálisis cerebral presentaron una mayor inestabilidad en la fase de ojos cerrados, en compensación utilizaron de manera significativamente mayor el sistema vestibular para mantener la posición de pie durante la evaluación del balance. Estos hallazgos explican cómo en ausencia de retroalimentación visual y en presencia de un sistema nervioso central con secuelas originadas en un daño ocurrido en la infancia, se exige una mayor respuesta del sistema vestibular. La literatura también hace alusión al mayor uso del sistema somatosensorial (14) en esta fase; sin embargo, en nuestro estudio no se observó contribución de este sistema.
Esta investigación aportó información sobre las diferencias en cuanto al balance y los sistemas sensoriales utilizados para mantener el control postural de pie entre personas con discapacidad física e individuos con desarrollo motor típico. Los resultados obtenidos y las diferencias observadas en el estudio permitirán orientar futuras investigaciones latinoamericanas, las cuales deberían centrarse en mejorar el balance y en la utilización eficiente de los sistemas sensoriales encargados del control postural en personas con parálisis cerebral.
Esta investigación fue financiada por la Dirección de Investigación de la Vicerrectoría Académica de la Universidad de Talca, proyecto I002839.
Los autores declaran no tener conflicto de intereses en esta investigación.
Correspondencia:
Valeska Gatica, Laboratorio de Control Motor Humano, Facultad de Ciencias de la Salud, Universidad de Talca, Avenida Lircay s/n, Talca, Chile.
Teléfono: (560) 7120 1746
vgatica@utalca.cl
1. Rosenbaum P, Paneth N, Leviton A, Goldstein M, Bax M, Damiano D, et al . A report: The definition and classification of cerebral palsy, April 2006. Dev Med Child Neurol. 2007;109(Suppl.):8-14.
2. Kuban K, Leviton A. Cerebral palsy. N Engl J Med. 1994;330: 188-95. http://dx.doi.org/10.1056/NEJM199406163302417
3. Woollacott MH, Shumway-Cook A. Postural dysfunction during standing and walking in children with cerebral palsy: What are the underlying problems and what new therapies might improve balance? Neural Plast. 2005;12:211-9. http://dx.doi.org/10.1155/NP.2005.211
4. Woollacott M, Shumway-Cook A, Hutchinson S, Ciol M, Price R, Kartin D. Effect of balance training on muscle activity used in recovery of stability in children with cerebral palsy: A pilot study. Dev Med Child Neurol. 2005 ;47:455-61. http://dx.doi.org/10.1111/j.1469-8749.2005.tb01171.x
5. McClenaghan BA, Thombs L, Milner M. Effects of seat-surface inclination on postural stability and function of the upper extremities of children with cerebral palsy. Dev Med Child Neurol. 1992 ;34:40-8.
6. Crenna P. Spasticity and ‘spastic´ gait in children with cerebral palsy. Neurosci Biobehav Rev. 1998 ;22:571-8. http://dx.doi.org/10.1016/S0149-7634(97)00046-8
7. Madhavan S, Shields RK. Influence of age on dynamic position sense: Evidence using a sequential movement task. Exp Brain Res. 2005;164:18-28. http://dx.doi.org/10.1007/s00221-004-2208-3
8. Robertson D, Caldwell G, Hamill J, Kamen G, Whittlesey S. Research Methods in Biomechanics. First edition. New York: Human Kinetics; 2004.
9. D uarte M, Freitas SM. Revision of posturography base d on force plate for balance evaluation. Rev Bras Fisioter. 2010 ; 14 : 183-92 . http://dx.doi.org/10.1590/S1413-35552010000300003
10. Collins JJ, De Luca CJ. Open-loop and closed-loop control of posture: A random-walk analysis of center of pressure trajectories. Exp Brain Res. 1993;95:308-18.
11. Lin D, Seol H, Nussbaum M, Madigan M. Reliability of COP- based postural sway measures and age-related differences. Gait & Posture. 2008;28:337-42. http://dx.doi.org/10.1016/j.gaitpost.2008.01.005
12. Hirabayashi S, Iwasaki Y. Developmental perspective of sensory organization on postural control. Brain Dev. 1995; 17:111-3. . http://dx.doi.org/10.1016/0387-7604(95)00009-Z
13. Shumway-Cook A, Woollacott MH. The growth of stability: postural control from a development perspective. J Mot Behav. 1985;17:131-47.
14. Steindl R, Kunz K, Schrott-Fischer A, Scholtz A. Effect of age and sex on maturation of sensory systems and balance control. Dev Med Child Neurol. 2006;48:477-82. http://dx.doi.org/10.1111/j.1469-8749.2006.tb01299.x
15. Palisano R, Rosenbaum P, Walter S, Russell D, Wood E, Galuppi B. Development and reliability of a system to classify gross motor function in children with cerebral palsy. Dev Med Child Neurol. 1997;39:214-23.
16. Palisano RJ, Cameron D, Rosenbaum PL, Walter SD, Russell D. Stability of the gross motor function classification system. Dev Med Child Neurol. 2006;48:424-8. http://dx.doi.org/10.1111/j.1469-8749.2006.tb01290.x
17. Palisano RJ, Rosenbaum P, Bartlett D, Livingston MH. Content validity of the expanded and revised Gross Motor Function Classification System. Dev Med Child Neurol. 2008; 50:744-50. http://dx.doi.org/10.1111/j.1469-8749.2008.03089.x
18. Cans C. Surveillance of cerebral palsy in Europe: A collaboration of cerebral palsy surveys and registers. Dev Med Child Neurol. 2000; 42:816-24. http://dx.doi.org/10.1111/j.1469-8749.2000.tb00695.x
19. Redfern M, Yardley L, Bronstein A. Visual influences on balance. J Anxiety Disord. 2001;15:81-94. http://dx.doi.org/10.1016/S0887-6185(00)00043-8
20. Greffou S, Bertone A, Hanssens JM, Faubert J. Development of visually driven postural reactivity: a fully immersive virtual reality study. J Vis. 2008;8:15.1-10. http://dx.doi.org/10.1167/8.11.15
21 . Donker SF, Ledebt A, Roerdink M, Savelsbergh GJ, Beek PJ. Children with cerebral palsy exhibit greater and more regular postural sway than typically developing children. Exp Brain Res. 2008 ; 184 :363-70. http://dx.doi.org/10.1007/s00221-007-1105-y
22. Hatzitaki V, Zisi V, Kollias I, Kioumourtzoglou E. Perceptual-motor contributions to static and dynamic balance control in children. J Mot Behav. 2002;34:161-70. http://dx.doi.org/10.1080/00222890209601938
23. Peterka RJ. Sensorimotor integration in human postural control. J Neurophysiol. 2002 ;88:1097-118.