ARTÍCULO ORIGINAL
doi: http://dx.doi.org/10.7705/biomedica.v34i3.1703
1 Facultad de Medicina, Universidad CES, Medellín, Colombia
2 Escuela de Medicina Veterinaria, Facultad de Ciencias Agrarias, Universidad de Antioquia, Medellín, Colombia
3 University of Texas Medical Branch, Galveston, Texas, USA
Contribución de los autores:
Piedad Agudelo-Flórez: análisis de la información y escritura del manuscrito
Piedad Agudelo-Flórez, Juan David Rodas y Bruno Travi: diseño original del estudio y revisión del manuscrito
Harold Durango: obtención, reporte y análisis de datos experimentales
Diego Aranzazu: obtención y análisis de datos histopatológicos
Recibido: 22/05/13; aceptado: 19/05/14
Introducción. Es necesario desarrollar modelos de estudio de la leptospirosis.
Objetivo. Genotipificar un aislamiento de Leptospira proveniente de una persona con síndrome de Weil y evaluar, con el modelo experimental en Mesocricetus auratus , su dinámica de infección.
Materiales y métodos. Se hizo la genotipificación por análisis de las secuencias génicas rrs 16S y lipL32 . Se determinó la dosis letal media en hámster inoculada por vía intraperitoneal. Se identificaron los patrones de química clínica, la duración de la leptospiremia, la leptospiruria y la histopatología, comparados con el mismo modelo inoculado con la cepa de Leptospira interrogans (Fiocruz L1-130).
Resultados. Mediante análisis molecular se determinó que el aislamiento correspondía a la especie patógena Leptospira santarosai . La bacteria se recuperó a partir de tejido de riñón y de pulmón, y se detectó por medio de PCR lipL32 en el tercer día después de la infección. La proteína C reactiva aumentó en el quinto día después de la infección (3,25 mg/dl; valor normal: 0,3 mg/dl) con una disminución en el día 18 (2,60 mg/dl; valor normal: 0,8 mg/dl). Los biomarcadores de urea mostraron alteraciones indicativas de falla renal aguda (día 5 después de la infección: 49,01 mg/dl y día 18: 53,71 mg/dl). La histopatología mostró neumonía intersticial con diferentes grados de hemorragia, así como nefritis intersticial.
Conclusión. Se identificó la presencia de la especie L. santarosai con capacidad patógena comparable con la cepa Fiocruz L1-130 de L. interrogans , de reconocida virulencia y tropismo pulmonar, en cuanto a los aspectos histopatológicos de tropismo a pulmón y riñón. Nunca antes se había evaluado en un modelo experimental un aislamiento de origen local bajo estos criterios biológicos.
Palabras clave: Leptospira , leptospirosis, patología, Mesocricetus , virulencia.
http://dx.doi.org/10.7705/biomedica.v34i3.1703
Genotyping and evaluation of infection dynamics in a Colombian isolate of Leptospira santarosai in hamster as an experimental model
Introduction: Is necessary to develop models for the study of leptospirosis.
Objective: To genotype a Colombian strain of Leptospira isolated from a human with Weil's syndrome and to evaluate its infection dynamics in the hamster experimental model.
Materials and methods: Genotyping was performed by amplification and sequence analysis of the rrs 16S and lipL32 genes. The median lethal dose was determined in intraperitoneally inoculated hamsters. The patterns of clinical chemistry, the duration of leptospiremia, leptospiruria and pathological findings were studied and compared in the same animal model infected with L. interrogans (Fiocruz L1-130).
Results: Molecular typing revealed that the isolate corresponded to the pathogenic species L. santarosai, which was recovered from hamsters´ kidneys and lungs and detected by lipL32 PCR from day 3 post-infection in these organs. There was a marked increase of C-reactive protein in animals at day 5 post-infection (3.25 mg/dl; normal value: 0.3 mg/dl) with decreases by day 18 (2.60 mg/dl: normal value: 0.8 mg/dl). Biomarkers of urea showed changes consistent with possible renal acute failure (day 5 post-infection: 49.01 mg/dl and day 18 post-infection: 53.71 mg/dl). Histopathological changes included interstitial pneumonia with varying degrees of hemorrhage and interstitial nephritis.
Conclusion: The pathogenic species L. santarosai was identified in Colombia. Its pathogenicity as determined by tropism to lung and kidney was comparable to that of L. interrogans Fiocruz L1-130, well known for its virulence and pulmonar tropism. The biological aspects studied here had never before been evaluated in an autochthonous isolate.
Key words: Leptospira , leptospirosis, pathology, Mesocricetus , virulence.
http://dx.doi.org/10.7705/biomedica.v34i3.1703
La leptospirosis es una de las enfermedades infecciosas zoonóticas más extendidas en el mundo, comúnmente asociada a áreas rurales y urbanas de zonas tropicales y subtropicales. La infección es producida por especies patógenas del género Leptospira , un grupo diverso compuesto por 21 especies, entre las que se encuentran ocho saprófitas o de vida libre, cinco de capacidad patógena intermedia y ocho claramente patógenas para humanos y huéspedes sensibles (1).
La infección en el humano se asocia al contacto directo de la piel o de las mucosas con la orina de animales salvajes o domésticos infectados que actúan como reservorios, o por contacto indirecto con orina en ambientes contaminados en los que las personas están expuestas a factores de riesgo ocupacional o recreativo-deportivo, o debido a inundaciones y desastres (2).
En el humano la enfermedad puede cursar con manifestaciones clínicas variables que van desde la infección subclínica (asintomática o estado febril indiferenciado con cefalea y mialgias) hasta la forma grave caracterizada por ictericia progresiva, falla renal y pulmonar, y alteraciones neurológicas y hemorragias, signos estos del síndrome de Weil, que puede ser fatal en 10 a 15% de los casos (1). El compromiso pulmonar es una característica emergente de la enfermedad, la cual fue descrita a partir de la epidemia de 1995 en Nicaragua (3) y, posteriormente, también caracterizada en Brasil (4,5), Argentina (6,7) y Perú (8), donde se reportan mortalidades entre 30 y 60 %. La leptospirosis se ha registrado en brotes en diferentes regiones de Colombia (9) y también de forma endémica en la población general (10-14).
Durante la última década, en el Instituto Colombiano de Medicina Tropical - Universidad CES se han obtenido 12 aislamientos de Leptospira sp. procedentes de humanos, animales y fuentes ambientales. Uno de ellos se clasificó en el nivel de serovariedad como Leptospira interrogans correspondiente al ST 17 Icterohaemorrhagiae/Copenhageni (15), gracias al uso de la secuenciación directa de múltiples locus ( Multi-Locus Sequence Typing , MLST). Igualmente, se dispone de nueve aislamientos más (11 en total), identificados como pertenecientes a especies patógenas de Leptospira en un estudio previo llevado a cabo por nuestro grupo (16) mediante reacción en cadena de la polimerasa (PCR) contra un gen exclusivo de leptospiras patógenas ( lipL3 2).
A pesar de que la leptospirosis presenta una gran importancia epidemiológica y clínica a nivel mundial por su condición de enfermedad reemergente, poco se sabe de los aislamientos colombianos en lo que respecta a su genotipificación y virulencia. En este estudio se presenta la genotipificación por secuencia directa de los genes lipL32 y rrs 16S de una de estas cepas colombianas de Leptospira aislada de una persona que, además de tener síndrome de Weil, también presentaba manifestaciones pulmonares asociadas con leptos pirosis. Se describe la evaluación del modelo experimental en hámster de la dinámica de infección del aislamiento mediante la valoración de la dosis letal media (DL 50 ), los patrones de química clínica, la leptospiremia, la leptospiruria y los hallazgos histopatológicos comparados con los presentados en el mismo modelo con la cepa de referencia L. interrogans , Fiocruz L1-130 .
Materiales y métodos
Cepas de Leptospira spp.
Cepa de referencia . Fue Leptospira interrogans serogrupo Icterohaemorrhagiae, serovar Copen hageni, cepa L1-130, donada por la Fundación Fiocruz de Brasil. Esta cepa fue aislada de un paciente durante el brote de leptospirosis de 1996 asociado a la inundación en Salvador de Bahía, Brasil, y desde entonces ha sido utilizada principalmente para estudios sobre la capacidad patógena en modelos animales (17-20).
Origen del aislamiento colombiano . La cepa JET fue aislada de un paciente de sexo masculino procedente de Apartadó, Colombia, que consultó por un cuadro febril de tres días de evolución consistente en fiebre, cefalea, malestar general, prurito ocular con inyección conjuntival, conjuntiva tarsal "empedrada", "ronchas perioculares" y tos persistente, pero sin signos meníngeos.
Se le practicó un hemocultivo en medio semisólido de Fletcher y prueba serológica IgM para Leptospira . La prueba serológica fue positiva y al paciente se le prescribió doxiciclina en dosis de 200 mg diarios durante 14 días, lográndose la remisión de los síntomas al cuarto día de tratamiento. El cultivo fue positivo, con lo cual se confirmó el diagnóstico de leptospirosis, y se usó para la extracción de material genético con fines de genotipificación y para obtener subcultivos mediante los métodos estándares (21) usados en los ensayos biológicos.
Genotipificación del aislamiento colombiano de Leptospira
Extracción de ADN genómico . El ADN se extrajo con un estuche comercial, el Wizard ADN de Promega ®, siguiendo el protocolo para bacterias Gram negativas y utilizando como volumen inicial 1 ml de cultivo del aislamiento (crecimiento 0,5, MacFarland). Después de la extracción, se rehidrató el ADN con solución tampón Tris-EDTA y se almacenó a 4 °C hasta el momento de su uso.
Reacción en cadena de la polimerasa. Para la reacción molecular de amplificación del gen rrs 16S , se usó la pareja de cebadores 16S RNA rrs F GGCGGCGCGTCTTAAACATG y 16S RNA rrs R TTCCCCCCATTGAGCAAGATT, descritos por Mérien, et al. , (22), cuyo producto de amplificación es de 331 pb. El perfil térmico y las concentraciones de reactivos utilizados para la estandarización de la PCR fueron 0,5 µl de cada cebador (0,4 µM), 0,5 µl de dNTPs (0,2 mM), 2,5 µl de solución tampón (1X), 1,5 µl de MgCl 2 (1,5 mM), 0,2 µl de Taq polimerasa (1 unidad/reacción), 18,3 µl de agua para PCR y 1 µl de ADN (200 ng/µl), para un volumen final de 25 µl en cada reacción. La PCR se realizó en un termociclador Perkin Elmer 9700 y el ciclo de amplificación fue el siguiente: un ciclo de desnaturalización inicial a 94 °C por 5 minutos, 35 ciclos de 94 °C por 45 segundos, 56 °C por 1 minuto, 72 °C por 2 minutos y, finalmente, se dejó a 72 °C por 5 minutos.
La reacción molecular para la PCR lipL3 2 se hizo con los iniciadores descritos por Levett, et al ., (23): lipL32 /270F (5´-GCTGAAATGGGAGTTCGT ATGATT-3´) y lipL32 /692R (5´-CAACAGATGCAA CGAAAGATCCTTT-3´), dirigidos al gen que codifica para la lipoproteína lipL32 , los cuales arrojaron un tamaño de 443 pb. Esta secuencia es conservada en las especies patógenas de Leptospira . El perfil térmico de la PCR lipL32 se estandarizó según Moreno y Agudelo-Flórez (16) con una temperatura de hibridación de 55 °C.
Electroforesis y secuencia. Los productos de la PCR se visualizaron utilizando la técnica de electroforesis en gel de agarosa con una concentración de 1,5 %. Se usó solución tampón TBE (Tris base, EDTA, ácido bórico) a una concentración de 1X, se le reveló con bromuro de etidio y se le agregó un marcador de peso molecular de 50 pb (Fermentas). Posteriormente, se realizó la electroforesis a 80 V durante una hora en cámara horizontal y, por último, se visualizó en un analizador de imagen EpiChemi3. El producto obtenido por la amplificación de cada gen fue enviado a Macrogen ® Corea para su secuenciación con los métodos estándar. Las secuencias obtenidas se compararon con aquellas disponibles en la base de datos de GenBank.
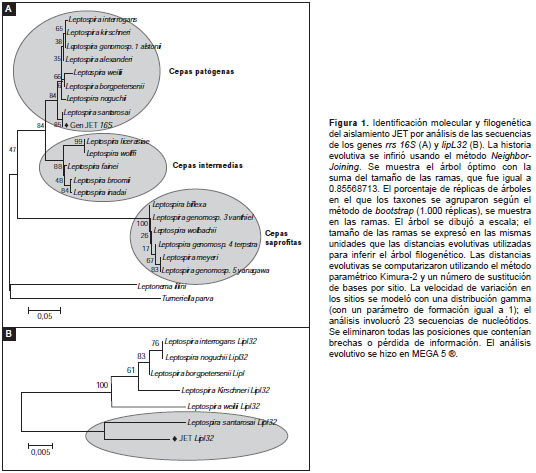
Análisis filogenético . Para los análisis filogenéticos se utilizaron como secuencias patrón los genes codificadores tanto para el gen ribosómico rrs 16S como para el gen lipL32 de 20 especies diferentes de Leptospira , abarcando de esta forma todas las especies según la actual clasificación molecular. Dichas secuencias, y las obtenidas a partir de este aislamiento, se alinearon mediante el programa bioinformático Clustal X y se analizaron con el programa filogenético MEGA 5®, utilizando para el análisis el método Neighbor-Joining con 1.000 réplicas; las distancias evolutivas se computari zaron usando el método paramétrico Kimura-2.
Infección experimental
Preparación del cultivo para el inóculo. Se revisó entre lámina y laminilla en el microscopio de campo oscuro una alícu ota de un tubo de cultivo de cada aislamiento de, aproximadamente, 1 a 2 semanas de subcultivo en medio de cultivo de Ellinghausen-McCullough-Johnson-Harris (EMJH), con el fin de evaluar la viabilidad y movilidad antes de usarse como base para la preparación del inóculo. La concentración del inóculo se ajustó inicialmente a 0,5 en el patrón de turbidez de McFarland, equivalente a 1 x 10 5 bacterias por ml, en un espectofotómetro VitecK II (bioMérieux) y, como solución calibradora, se usó el medio EMJH estéril. A partir de la suspensión de 1 x 10 5 bacterias por ml, se hicieron diluciones dobles de 1 ml de solución del cultivo inicial en 9 ml de medio EMJH estéril, para así obtener las concentraciones de cada inóculo de 1 x 10 4, 1 x 10 3 y 1 x 10 2 bacterias por ml.
Modelo animal . Se utilizaron machos y hembras de hámster sirio dorado de 45 a 60 g de peso, procedentes del bioterio de la Sede de Investigación Universitaria (SIU) de la Universidad de Antioquia. En estas instalaciones los animales se mantuvieron a una temperatura de 18-22 °C, humedad relativa de 50 a 70 %, fotoperiodo de 12 horas de luz y 12 de oscuridad, alimentados con concentrado comercial pulverizado y esterilizado. Todas las condiciones y procedimientos se ajustaron a las guías internacionales para el manejo y cuidado de los animales (24).
Reactivación de cepas de Leptospira spp. Para fines de reproducibilidad y estandarización, antes del inicio de los ensayos experimentales las dos cepas de Leptospira se reactivaron como se describe a continuación. Por cada cepa se inocularon dos hámsteres con 1 ml de una suspensión a una concentración bacteriana mayor de 1 x 10 8 bacterias por ml. Cuando los animales presentaban mal estado general, se anestesiaban (ketamina/xilacina en dosis de 200/10 mg/kg de peso) y se sangraban antes de su muerte para recuperar el aislamiento en medio de cultivo EMJH (Difco). De esta sangre se disolvieron 100 µl en 400 µl de solución salina estéril para inyectar a un nuevo hámster. Este procedimiento se repitió dos veces más en intervalos de dos semanas para reactivar la virulencia de cada uno de los aislamientos. A los aislamientos así recuperados se les realizaron dos nuevos pases in vitro en el medio EMJH, con lo que estuvieron listos para usarse en la infección experimental.
Valoración de la dosis letal media
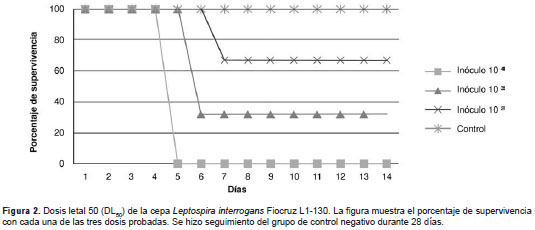
La virulencia de las cepas se estimó cuantitativamente en el modelo de hámster mediante la determinación de la dosis letal media (DL 50 ) según la metodología propuesta por Fajardo, et al. , (25). Se inocularon por vía intraperitoneal grupos de tres hámsteres con diluciones seriadas (1 x 10 4, 1 x 10 3 y 1 x 10 2 bacterias por ml) de cada una de las cepas. Los animales se vigilaron diariamente durante 28 días después de la infección para observar la presentación de signos clínicos de enfermedad, incluida la deshidratación, el pelaje erizado, el decrecimiento de la actividad, el aislamiento o la muerte. Los animales usados como control negativo fueron inoculados con los mismos volúmenes de medio EMJH estéril. Todos los aislamientos se evaluaron en tres experimentos independientes. La DL 50 se calculó según la metodología propuesta por la Organización para la Cooperación y el Desarrollo Económicos (OCDE) en los lineamientos para la aplicación de las pruebas de productos químicos (26).
Cinética de la infección
Se evaluó la cinética de la infección tanto de la cepa de referencia Fiocruz L1-130 como de la cepa colombiana JET. De cada grupo de evaluación y de cada cepa, se inocularon tres hámsteres y se usó uno más como control negativo. Los grupos experimentales se distribuyeron para cada punto de evaluación de la cinética de infección. Se establecieron 14 puntos de evaluación: 2, 4, 8, 14, 24, 48, 72, 96 horas, y 5, 10, 15, 18, 21 y 28 días después de la infección. Cada animal se infectó bajo las condiciones ya señaladas, usando un inóculo de 1 x 10 3 bacterias por ml con base en la DL 50 determinada anteriormente. Los hámsteres de control negativo se inocularon con 1 ml de medio de cultivo EMJH estéril.
Los animales se observaron dos veces al día durante el tiempo del experimento, para evaluar la presencia de signos clínicos, incluidos la deshidratación, el pelaje erizado, el decrecimiento de la actividad y el aislamiento. El momento en que los animales presentaban tres o más de estos síntomas, se consideró como punto final del experimento y se procedió a anestesiarlos (ketamina/xilacina en dosis de 200/10 mg/kg de peso) para tomar la muestra de sangre y someterlos a eutanasia (cámara de CO 2 ).
Toma de muestras y necropsia
Para optimizar la muestra, se usaron puntos variables de evaluación en los diferentes individuos, con el fin de establecer la cinética de la infección sanguínea. Se tomaron muestras de sangre por vía cardiaca con anticoagulante y sin este, para determinar los patrones de química clínica, la leptospiremia y la cinética histopatológica. Se procedió a bañar el cuerpo del animal anestesiado con una solución de amonio cuaternario para la desinfección y posterior toma de la muestra sanguínea por punción cardíaca.
El suero se recuperó por centrifugación de la sangre a 15.000 rpm y se conservó a -20 °C hasta el momento del procesamiento. Una alícuota de este suero se usó para determinar los parámetros de química sanguínea, los marcadores de respuesta inflamatoria (proteína C reactiva) y el perfil renal (urea, nitrógeno ureico en sangre y creatinina). Este procedimiento se llevó a cabo en el Laboratorio de Veterinaria y Zootecnia del Instituto Colombiano de Medicina Tropical-Universidad CES.
Otra alícuota se utilizó para determinar anticuerpos mediante la prueba serológica de microaglutinación ( Microscopic Agglutination Test , MAT ) según las especificaciones de la Organización Mundial de la Salud (OMS) (21) y usando como antígeno la cepa correspondiente a cada infección experimental. Se consideró como punto de corte de resultado positivo un título igual o superior a 1:50.
La necropsia comenzó por la cavidad torácica y finalizó por la cavidad abdominal. En cada caso se hizo una descripción macroscópica del estado de los órganos blanco (pulmón y riñón) y se procedió a hacer los cortes de tejido correspondientes. Una porción de cada tejido se preservó en formol tamponado al 10 % para la evaluación histológica y otra porción se depositó en solución salina para la extracción de material genómico con el fin de hacer el seguimiento molecular mediante la PCR lipL32 . Una tercera muestra se trituró y se sembró en medio líquido EMJH libre de antibióticos y se incubó en condiciones de aerobiosis entre 28 y 30 °C. Estos cultivos se evaluaron al microscopio de campo oscuro cada ocho días durante cuatro semanas.
Análisis histológico
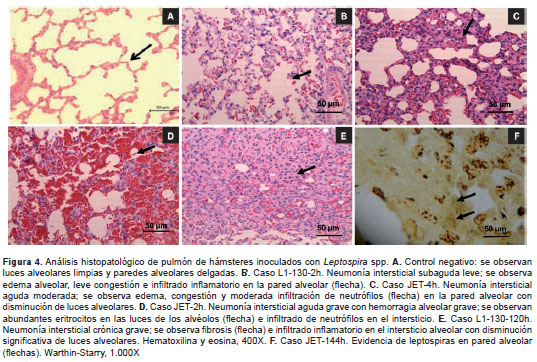
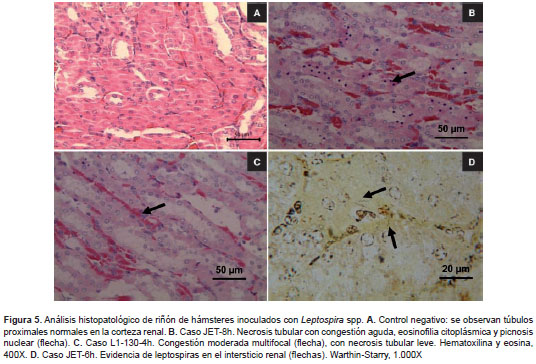
Las muestras de riñón y pulmón se procesaron por técnicas histológicas convencionales, obteniendo cortes de 5 µm de espesor. Todas las muestras se colorearon con hematoxilina y eosina para determinar cambios histopatológicos y, además, se les aplicó la coloración de Warthin-Starry para establecer la presencia de formas indicativas de Leptospira spp. en los tejidos (27).
Aspectos éticos
El protocolo fue sometido a consideración y estudio del Comité de Ética para la Experimentación con Animales de la Sede de Investigación Universitaria y aprobado mediante el acta 51 del 18 de mayo de 2009.
Resultados
Genotipificación del aislamiento colombiano de Leptospira
Las dos reacciones de PCR hechas con iniciadores para los genes lipL32 y rrs 16S fueron positivas y tipificaron el aislamiento como perteneciente a una especie patógena de Leptospira . Al comparar el análisis por secuenciación de los productos de amplificación de los genes lipL32 (443pb) y rrs 16S (331 pb) de Leptospira con los disponibles en la base de datos del GenBank, se obtuvo un porcentaje de identidad de 96 a 97 % con la especie L. santarosai en los dos genes. En la figura 1 se presenta el dendrograma generado por el análisis filogenético de los dos genes.
Caracterización de la virulencia en modelo experimental
Valoración de la dosis letal media (DL 50 ). Los animales inoculados con la cepa de referencia L1- 130 presentaron pérdida de la constitución corporal (pérdida de peso, pelaje erizado), apariencia ictérica de sus mucosas y deshidratación grave, y murieron entre los días 5 y 7 después de la infección. Se determinó de esta forma que la DL 50 correspondía a un número entre 1 x 10 2 y 1 x 10 3 bacterias por ml (35-40 % de supervivencia). Esto significa que se requieren entre 100 y 1.000 leptospiras para causar la muerte del 50 % de la población de animales inoculados (figura 2).
En el caso del grupo inoculado con la cepa de Leptospira colombiana, el signo clínico observado fue la ictericia de mucosas, evidenciada después del día 15 después de la infección. No hubo mortalidad en ninguno de los grupos inoculados con las diferentes concentraciones de esta cepa durante el período de 28 días de seguimiento.
Análisis de los parámetros de química clínica para el aislamiento colombiano
En cuanto a la valoración de los resultados de química clínica del presente trabajo, se verificó que los valores encontrados en el control negativo (animal no inoculado) estuvieran dentro de los rangos establecidos previamente como normales por el bioterio de la Sede de Investigación Universitaria (comunicación personal). El grupo inoculado con la cepa colombiana JET mostró alteraciones con respecto al control en los días 5 y 18 después de la infección. La proteína C reactiva presentó un aumento entre 2 y 7,5 veces por encima del valor límite en el día 5 después de la infección en todos los animales. En siete de los nueve animales inoculados con la cepa JET, se encontró una tendencia a la baja en el día 18 después de la infección, mientras que en dos animales, los valores fueron superiores en comparación con los del día 5 después de la infección.
En lo relacionado con los marcadores de perfil renal, los niveles de urea fueron mayores en cinco de los nueve animales, encontrándose aumentos entre 1,1 y 1,8 veces por encima del valor límite en el día 5 después de la infección (hámster con JET número 8: HJET-8: 28,8 mg/dl y HJET-1: 49,01 mg/dl). En el día 18 después de la infección se encontró que todos los animales inoculados con la cepa JET tenían valores entre 1,5 y 2 veces por encima del valor límite (HJET-7: 38,52 mg/dl y HJET-6: 53,71 mg/dl), lo cual coincidió con los hallazgos de nitrógeno ureico en sangre. Sin embargo, los niveles de creatinina permanecieron dentro del rango de los controles normales.

Cinética de los anticuerpos
La respuesta serológica fue positiva desde el día 6 después de la infección tanto para la cepa Fiocruz L1-130, con un título de 1:50, como para la cepa colombiana JET, que presentó un título de 1:200. En las mediciones correspondientes a los días 15 y 21 después de la infección el título de anticuerpos para la cepa JET se mantuvo en 1:200. Por otra parte, para la cepa Fiocruz se observó una elevación de títulos de 1:100 en el día 15 después de la infección, que permanecía en este mismo nivel en la medición del día 21 después de la infección.
Cinética de la invasión de Leptospira en tejidos de pulmón y riñón
Los cultivos de tejido de riñón fueron positivos en el día 5 después de la infección para ambas cepas. En el caso de los cultivos de pulmón del grupo inoculado con la cepa colombiana, solo uno de tres animales fue positivo en los días 6 y 7 después de la infección. No hubo cultivos positivos para estos animales después del día 9 después de la infección. No se obtuvieron cultivos positivos de este órgano en el grupo inoculado con la cepa Fiocruz en ninguno de los puntos evaluados.
Dada la baja sensibilidad del cultivo para el seguimiento de la invasión de los órganos, se hicieron evaluaciones adicionales de la invasión con coloración de Warthin-Starry y PCR lipL32 . Dicha coloración fue positiva en riñón en ambas cepas desde el día 5 después de la infección, lo que coincidió con la recuperación obtenida por cultivo. Por su parte, la PCR fue positiva en el tejido pulmonar y en el renal para las dos cepas evaluadas en el día 3 después de la infección.
Cinética del daño en los órganos
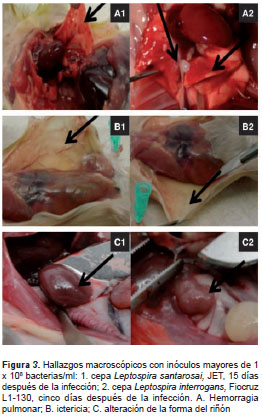
La revisión macroscópica hecha durante las necropsias de punto final en algunos animales, mostró signos de hemorragia pulmonar, ictericia en tejidos y alteración de la forma del riñón en los dos grupos experimentales. La (figura 3) muestra estos hallazgos para cada una de las cepas evaluadas experimentalmente.
La evaluación histopatológica de la cepa Fiocruz L1-130, realizada con la coloración de hematoxilina y eosina a las 2, 4, 8, 14, 24, 48, 72 y 96 horas, mostró neumonía intersticial en sus formas leves, evidenciadas a las dos horas de evaluación, y en las formas moderadas, que se mantuvieron hasta las 24 horas después de la infección. En el caso de la cepa JET, se presentó neumonía intersticial moderada desde el primer momento de evaluación (2 horas después de la infección) hasta las 96 horas después de la infección. La (figura 4) muestra estos hallazgos en cada una de las cepas evaluadas experimentalmente.
La evaluación histopatológica del riñón de la cepa Fiocruz L1-130, llevada a cabo en las horas ya señaladas, evidenció congestión leve multifocal con necrosis tubular leve multifocal a las 2 horas después de la infección hasta llegar a formas graves a las 24 horas después de la infección. En el caso de la cepa colombiana JET, se evidenció inicialmente (2 horas después de la infección) congestión multifocal leve que llegó hasta necrosis tubular multifocal entre las 4 y las 96 horas después de la infección (figura 5). En el día 5 después de la infección se encontró congestión renal leve a moderada con necrosis leve; en el día 18 después de la infección la congestión renal era moderada multifocal, con glomerulonefritis moderada multi focal, presencia de cilindros proteicos leves focales, y necrosis tubular leve focal y multifocal.
Discusión
Este artículo presenta la genotipificación y evaluación de la dinámica de infección de un aislamiento de L. santarosai , especie con reconocida capacidad patógena (1), obtenida de un paciente colombiano y nunca antes registrada en el país. Esta especie fue propuesta como nueva por Yasuda, et al ., (28) con base en un análisis fenotípico y de homología de su material genético (ADN) y debe su nombre a Carlos Santa Rosa, veterinario brasileño, pionero en el estudio de la leptospirosis en ese país. Los serogrupos que se registran en esta especie son Shermani, Hebdomanis y Tarassovi. La cepa tipo LT 821 fue aislada de una rata semiespinosa ( Proechimys semispinosus ) procedente de la zona del canal de Panamá (29).
En un estudio posterior, Brenner, et al., (30) confirmaron y ampliaron estos hallazgos, presentando 65 cepas pertenecientes a L. santarosai, en su mayoría originarias de Norteamérica y Suramérica, y en menor número, de China. El estudio muestra que 22 de estas cepas provenían de aislamientos en humanos; una de ellas fue aislada de Sri Lanka, en tanto que 21 eran de origen americano, de las cuales 14 habían sido aisladas en Panamá.
Existen pocos reportes de casos de infección en humanos por L. santarosai . Yang, et al., (31) registraron 12 casos procedentes de Taiwán con síndrome de Weil ocasionado por el serovar Shermani. Posteriormente, Valverde, et al., (32) reportaron un aislamiento de L. santarosai en humanos con síndrome de Weil en Costa Rica. El hallazgo en este trabajo es de importancia epidemiológica, ya que permite incrementar el conocimiento de las cepas que circulan en algunas regiones de Colombia (como el Urabá antioqueño) y caracterizar la enfermedad que ocasionan. Por otro lado, este aislamiento está disponible para futuros estudios orientados a identificar antígenos útiles en la producción de vacunas a partir de cepas autóctonas.
La evaluación del aislamiento colombiano mostró que, a diferencia de la cepa Fiocruz L1-130, la cepa JET no produjo una enfermedad grave en el modelo de hámster, lo cual podría relacionarse con las infecciones subclínicas detectadas serológicamente y el bajo reporte de casos procedentes de la zona de Urabá (Arboleda M, Agudelo-Flórez P, Parra G, Tangarife C, Ochoa J. Perfil epidemiológico y clínico de los pacientes con leptospirosis, Urabá, Antioquia. Biomédica. 2011; 31(Supl.1):81). A pesar de esto, el análisis de los biomarcadores de química clínica en los hámsteres mostró un aumento en los niveles séricos de proteína C reactiva. Esta proteína es sintetizada en el hígado en respuesta a procesos infecciosos, inflamatorios y de injuria tisular, y participa en procesos de inmunomodulación, como la amplificación del complemento, la 'opsonización' de bacterias y la estimulación de células fagocíticas (33,34).
Los marcadores de la función renal mostraron un aumento moderado de los niveles de urea sérica y nitrógeno ureico en sangre, pero niveles normales de creatinina. Estas alteraciones bioquímicas usualmente se presentan en casos de falla renal aguda, lo que, sumado a la deshidratación producida por un proceso infeccioso e inflamatorio sin reposición adecuada de líquidos, puede exacerbar el compromiso intrínseco renal ocasionado por la espiroqueta (35-37). Todas estas alteraciones son características del síndrome de Weil, en el que se generan cambios en hígado y riñón, los principales órganos blanco en la patogenia de la enfermedad (34-37).
Los hallazgos histopatológicos también demos traron la capacidad invasiva de la cepa colombiana, pues se observó neumonía intersticial acompañada de hemorragia alveolar y bronquiolar con diversa gravedad, así como nefritis intersticial con necrosis tubular. Estos hallazgos podrían ser comparables a los presentados por los animales inoculados con la cepa de referencia Fiocruz L1-130. En general, se demostró que, aunque la cepa no produce signos clínicos de gravedad, sí genera cambios funcionales e histopatológicos en los órganos blanco similares a los reportados por Nally, et al., en cobayos (38) y, posiblemente, comparables con los reseñados por Arean, et al., en humanos (39).
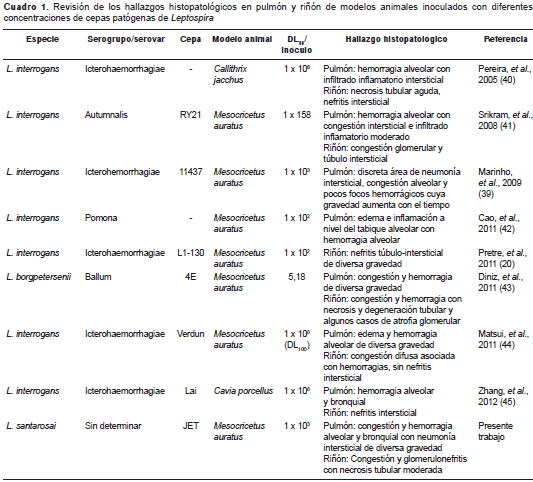
En el cuadro 1 se presenta una revisión comparativa de la literatura científica que ilustra y amplía los hallazgos histopatológicos obtenidos tanto en el modelo en hámster como en otros modelos experimentales con diferentes cepas de Leptospira spp. (20,39-45). Entre estos hallazgos resaltamos los estudios en hámster y tití común ( Callithrix jacchus ) con especies patógenas de diferente origen y bajo diferentes protocolos de infección. En estas infecciones se encontraron lesiones pulmonares y de riñón que variaban de leves a graves, semejantes a las encontradas en el presente estudio en el modelo de hámster infectado con L. santarosai (40-43) . Del mismo modo, Arean, et al., (39) en las necropsias de casos fatales en humanos, describieron diferentes grados de compromiso pulmonar, particularmente los caracterizados por áreas de hemorragia, edema y congestión alveolar, lo que se asemeja a lo encontrado en este estudio en el modelo de hámster- L. santarosai .
La capacidad invasiva de L. santarosai en los órganos blanco (pulmón, riñón) del hámster se pudo demostrar mediante la coloración de Warthin-Starry, el aislamiento en cultivo a partir del triturado de estos órganos y el resultado positivo en la PCR lipL32 . Esta capacidad invasiva se asoció a las alteraciones macroscópicas y microscópicas de estos órganos estudiados en algunos modelos animales (17,41). A pesar de que la recuperación por cultivo de Leptospira spp. en tejido pulmonar es difícil, la presencia de antígenos de esta bacteria en las lesiones del tejido pulmonar detectados por inmunohistoquímica en otros estudios (46,47) podría sugerir una acción directa de los microrganismos o sus productos en la generación de las lesiones típicas del síndrome de hemorragia pulmonar por leptospirosis. El daño en el tejido pulmonar se explica por dos mecanismos: la producción de endotoxinas por parte del microorganismo, las cuales median la vasculitis capilar, que es causa probada de la hemorragia pulmonar, o por citocinas producidas por el huésped como producto de la inducción de la respuesta inmunitaria por parte del patógeno; incluso, ambos podrían explicar dicho daño (48). En pacientes fallecidos con síndrome pulmonar hemorrágico por leptospirosis, se han encontrado depósitos de inmunoglobulinas y la fracción C3 del complemento en la superficie de los alvéolos. Además, la sobreproducción de los derivados del óxido nítrico explica el daño de los vasos sanguíneos y la infiltración celular que desencadena la neumonía intersticial con edema franco y hemorragia (49).
Se observó una respuesta de inflamación aguda en el pulmón de los hámsteres infectados con L. santarosai , con hemorragia pulmonar de diversa gravedad. Los resultados obtenidos en los diferentes tiempos después de la infección coinciden con lo encontrado por otros autores en diferentes modelos animales utilizando otras especies patógenas (40,48,49). Estos resultados también concordaron con la fisiopatología observada en los 12 casos en humanos registrados en Taiwán, en los cuales se demostró el compromiso pulmonar, renal y hepático desencadenado por L. santarosai. No debe olvidarse, no obstante, que existen diferencias entre los hallazgos en el modelo animal y la historia natural de la infección en humanos, en quienes se presentan incluso debido a los diferentes orígenes geográficos.
La valoración serológica mediante la prueba serológica de microaglutinación determinó que, aunque ambas cepas indujeron la producción de anticuerpos a partir del día 6 después de la infección, los títulos tendieron a ser mayores en algunos animales inoculados con la cepa JET comparados con los inoculados con la cepa de referencia Fiocruz L1-130. Este hallazgo sugiere que la modulación de la respuesta inmunitaria está determinando la presentación de signos clínicos y, por consiguiente, la evolución final de la enfermedad (20,31,33).
En conclusión, se identificó por primera vez en Colombia la presencia de la especie patógena L. santarosai en humanos, con una identidad de 96 a 97 % al compararla con las secuencias reportadas para los genes lipL 32 y 16S en el GenBank. El daño histopatológico en pulmón y riñón se presentó igual que con la cepa Fiocruz L1-130 de L. interrogans , de reconocida virulencia y tropismo pulmonar. Las alteraciones histopatológicas en la infección con L. santarosai fueron semejantes a las reportadas por otros autores en casos humanos con formas graves de la enfermedad (31).
Este estudio sienta las bases para evaluar el tratamiento y la respuesta inmunitaria de la leptospirosis humana en Colombia mediante un modelo animal ampliamente empleado en esta infección. Sería pertinente, asimismo, utilizar la especie L. santarosai , cuyo genoma completo ya está establecido (50), como uno de los componentes para el desarrollo de futuras vacunas de potencial utilidad en el medio local.
Los autores declaramos que no existen conflictos de intereses.
Al personal del Bioterio de la Sede de Investigación de la Universidad de Antioquia.
Este estudio recibió financiación del Departamento Administrativo de Ciencia, Tecnología e Innovación, Colciencias, Colombia (códigos de proyecto 325645221265 - 352-2008 y 325649326207-678).
Correspondencia: Piedad Agudelo-Flórez, Universidad CES, Calle 10 A N° 22-04, Medellín, Colombia Teléfono: (574) 444 0555, extensión 1263 pagudelo@ces.edu.co
1. Ko AI, Goarant C, Picardeau M. Leptospira: The dawn of the molecular genetics era for an emerging zoonotic pathogen. Nat Rev Micro. 2009;7:736-47. http://dx.doi.org/10.1038/nrmicro2208
2. Bharti AR, Nally JE, Ricaldi JN, Matthias MA, Díaz MM, Lovett MA, et al . Leptospirosis: A zoonotic disease of global importance. Lancet Infect Dis. 2003;3:757-71. http://dx.doi.org/10.1016/S1473-3099(03)00830-2
3. Trevejo RT, Rigau-Pérez JG, Ashford DA, McClure EM, Jarquin-González C, Amador JJ, et al . Epidemic leptospirosis associated with pulmonary hemorrhage- Nicaragua, 1995. J Infect Dis. 1998;178:1457-63. http://dx.doi.org/1010.1086/314424
4. Silva JJP, Manhães de Carvalho JE, Xavier MM, Lutz TM, Setúbal S, Dalston MO. Forma pulmonar grave da leptospirose (FPGL): uma nova apresentação clínica da doença no Estado do Rio de Janeiro, Brasil. Arquivos Brasileiro de Medicina. 1998;72:169-71.
5. Ko AI, Reis MG, Dourado CMR, Johnson WD, Riley LW. Urban epidemic of severe leptospirosis in Brazil. Lancet. 1999;354:820-5. http://dx.doi.org/10.1016/S0140-6736(99)80012-9
6. Seijo A, Coto H, San Juan J, Videla J, Deodato B, Cernigo B, et al . Distrés respiratorio debido a hemorragia pulmonar por leptospirosis. Medicina (Buenos Aires). 2002;62:135-40.
7. Seijo A, Coto H, San Juan J, Videla J, Deodato B, Cernigoi B, et al. Lethal leptospiral pulmonary hemorrhage: An emerging disease in Buenos Aires, Argentina. Emerg Infect Dis. 2002;8:1004-5. http://dx.doi.org/10.3201/eid0809.010499
8. Segura ER, Ganoza CA, Campos K, Ricaldi JN, Torres S, Silva H, et al . Clinical spectrum of pulmonary involvement in leptospirosis in a region of endemicity, with quantification of leptospiral burden. Clin Infect Dis. 2005;40:343-51. http://dx.doi.org/10.1086/427110
9. Epstein PR, Calix Pena O, Blanco Racedo J. Climate and disease in Colombia. Lancet. 1995;346:1243-4. http://dx.doi.org/10.1016/S0140-6736(95)91856-6
10. Sebek Z, Sixl W, Valova M, Marth E, Kock M, Reinthaler FF. Serological investigations for leptospirosis in humans in Columbia. Geogr Med Suppl. 1989;3:51-60.
11. Ferro B, Rodríguez A, Pérez M, Travi B. Seroprevalencia de infección por Leptospira en habitantes de barrios peri- féricos de Cali. Biomédica. 2006;26:270-7.
12. Góngora A, Parra J, Aponte L, Gómez L. Seroprevalencia de Leptospira spp. en grupos de población de Villavicencio, Colombia. Rev Salud Pública. 2008;10:269-78. http://dx.doi.org/10.1590/S0124-00642008000200007
13. Agudelo-Flórez P, Restrepo-Jaramillo B, Arboleda-Naranjo M. Situación de la leptospirosis en el Urabá antioqueño colombiano: estudio seroepidemiológico y fac- tores de riesgo en población general urbana. Cad Saúde Pública. 2007;23:2094-102. http://dx.doi.org/10.1590/S0102-311X2007000900017
14. Padmanabha H, Hidalgo M, Valbuena G, Castañeda E, Galeano A, Puerta H, et al . Geographic variation in risk factors for SFG rickettsial and leptospiral exposure in Colombia. Vector Borne Zoonotic Dis. 2009;9:483-90. http://dx.doi.org/10.1089/vbz.2008.0092
15. Szonyi B, Agudelo-Flórez P, Ramírez M, Moreno N, Ko AI. An outbreak of severe leptospirosis in capuchin (Cebus) monkeys. Vet J. 2011;188:237-9. http://dx.doi.org/10.1016/j.tvjl.2010.05.002
16. Moreno N, Agudelo-Flórez P. Aplicación de las pruebas de PCR convencional simple y múltiple para la identificación de aislamientos de Leptospira spp. en Colombia. Rev Perú Med Exp Salud Pública. 2010;27:548-56. http://dx.doi.org/10.1590/S1726-46342010000400009
17. Silva EF, Santos CS, Athanazio DA, Seyffert N, Seixas FK, Cerqueira GM, et al . Characterization of virulence of Leptospira isolates in a hamster model. Vaccine. 2008; 26:3892-6. http://dx.doi.org/10.1016/j.vaccine.2008.04.085
18. Lourdault K, Aviat F, Picardeau M. Use of quantitative real-time PCR for studying the dissemination of Leptospira interrogans in the guinea pig infection model of leptospirosis. J Med Microbiol. 2009;58:648-55. http://dx.doi.org/10.1099/jmm.0.008169-0
19. Atzingen MV, Gonçales AP, de Morais ZM, Araujo ER, De Brito T, Vasconcellos SA, et al . Characterization of leptospiral proteins that afford partial protection in hamsters against lethal challenge with Leptospira interrogans . J Med Microbiol. 2010;59:1005-15. http://dx.doi.org/10.1099/jmm.0.021485-0
20. Pretre G, Olivera N, Cedola M, Haase S, Alberdi L, Brihuega B, et al . Role of inducible nitric oxide synthase in the pathogenesis of experimental leptospirosis. Microb Pathog. 2011;51:203-8. http://dx.doi.org/10.1016/j.micpath.2011.03.011
21. World Health Organization. Human leptospirosis: Guidance for diagnosis, surveillance and control, 2003. Fecha de consulta: 4 de diciembre de 2012. Disponible en: http://www.med.monash.edu.au/microbiology/staff/adler/leptoguidelines2003.pdf.
22. Mérien F, Amouriaux P, Perolat P, Baranton G, Saint Girons I. Polymerase chain reaction for detection of Leptospira spp. in clinical samples. J Clin Microbiol. 1992; 30:2219-24.
23. Levett P, Morey R, Galloway R, Turner D, Steigerwaltand A, Mayer L. Detection of pathogenic leptospires by real- time quantitative. J Med Microbiol 2005;54:45-9. http://dx.doi.org/10.1099/jmm.0.45860-0
24. Instituto Nacional de Tecnología Agropecuaria. Guía para cuidado y uso de animales de experimentación. Buenos Aires: Centro de Investigación en Ciencias Veterinarias; 2002.
25. Fajardo EM, Ortiz B, Chávez A, Gainza N, Izquierdo L, Hernández Y, et al . Normalización de la dosis letal 50 de las cepas de Leptospira interrogans utilizadas en el control de la vacuna antileptospirósica cubana para uso humano. Rev Cubana Med Trop. 1998;50:22-6.
26. Organization for Economic Cooperation and Development -OECD. Acute oral toxicity – acute toxic class method. Environmental Health and Safety; 2001. Fecha de consulta: 17 de julio de 2009. Disponible en: http://iccvam.niehs.nih.gov/SuppDocs/FedDocs/OECD/OECD_GL423.pdf.
27. Faine S, Adler B, Bolin C, Perolat P. Leptospira y leptos-pirosis. Second edition. Melbourne: MediSci Press; 1999.
28. Yasuda P, Steigerwalt A, Sulzer K, Kaufmann A, Rogers F, Brenner D. Deoxyribonucleic acid relatedness between serogroups and serovars in the family Leptospiraceae with proposals for seven new Leptospira species. Int J Syst Bacteriol. 1987;37:407-15 . http://dx.doi.org/10.1099/00207713-37-4-407
29. Brenner D, Kaufmann A, Sulzer K, Steigerwalt A, Rogers F, Weyant R. Further determination of DNA relatedness between serogroups and serovars in the family Leptospiraceae with a proposal for Leptospira alexanderi sp. nov. and four new Leptospira genomospecies. Int J Syst Bacteriol. 1999;49:839-58. http://dx.doi.org/10.1099/00207713-49-2-839
30. Yang C, Wu M, Pan M. Leptospirosis renal disease. Nephrol Dial Transplant. 2001;16(Suppl.5):73-7. http://dx.doi.org/10.1093/ndt/16.suppl_5.73
31. Valverde M, Ramírez J, Montes de Oca L, Goris M, Ahmed N, Hartskeerl R. Arenal, a new Leptospira serovar of serogroup Javanica, isolated from a patient in Costa Rica. Infect Genet Evol. 2008;8:529-33. http://dx.doi.org/10.1016/j.meegid.2008.02.008
32. Prietoa M, Kilsteina J, Bagileta D, Pezzottob S. Proteína C reactiva como factor pronóstico de mortalidad en la unidad de cuidados intensivos. Med Intensiva. 2008;32:424-30.
33. Covic A, Maftei ID, Gusbeth-Tatomir P. Acute liver failure due to leptospirosis successfully treated with MARS (molecular adsorbent recirculating system) dialysis. Int Urol Nephrol. 2007;39:313-6. http://dx.doi.org/10.1007/s11255-006-9102-9
34. Durmaz B, Harmankaya M, Hasman H, Gunduz A, Oktar M, Seber E. Acute renal failure: A common manifestation of leptospirosis. Renal Failure. 2004;26:655-61.
35. Covic A, Goldsmith D, Gusbeth-Tatomir P, Seica A, Covic M. A retrospective 5-year study in Moldova of acute renal failure due to leptospirosis: 58 cases and a review of the literature. Nephrol Dial Transplant 2003;18:1128-34. http://dx.doi.org/10.1093/ndt/gfg095
36. Abdulkader R, Silva M. The kidney in leptospirosis. Pediatr N ephrol. 2008;23:2111-20. http://dx.doi.org/10.1007/s00467-008-0811-4
37. Nally J, Chantranuwat C, Wu X, Fishbein M, Pereira M, Pereira J, et al . Alveolar septal deposition of immunoglobulin and complement parallels pulmonary hemorrhage in a Guinea pig model of severe pulmonary leptospirosis. Am J Pathol. 2004;164:1115-27. http://dx.doi.org/10.1016/S0002-9440(10)63198-7
38. Arean V. The pathologic anatomy and pathogenesis of fatal human leptospirosis (Weil's disease). Am J Pathol. 1962;40:393-423.
39. Marinho M, Oliveira-Júnior IS, Monteiro CM, Perri SH, Salomão R. Pulmonary disease in hamsters infected with Leptospira interrogans : Histopathologic findings and cytokine mRNA expressions. Am J Trop Med Hyg. 2009;80:832-6.
40. Pereira M, Pereira J, Pinto M, França da Silva M, Machado M, Lenzi H, et al . Experimental leptospirosis in marmoset monkeys ( Callithrix jacchus ): A new model for studies of severe pulmonary leptospirosis. Am J Trop Med Hyg. 2005;72:13-20.
41. Srikram A, Wongratanacheewin S, Puapairoj A, Wuthiekanun V, Sermswan RW. Analyses of vaccination protocols for Leptospira interrogans serovar autumnalis in hamsters. Am J Trop Med Hyg. 2008;79:779-86.
42. Cao Y, Faisal SM, Yan W, Chang YC, McDonough SP, Zhang N, et al . Evaluation of novel fusion proteins derived from extracellular matrix binding domains of LigB as vaccine candidates against leptospirosis in a hamster model. Vaccine. 2011;29:7379-86. http://dx.doi.org/10.1016/j.vaccine.2011.07.070
43. D iniz JA, Félix SR, Bonel-Raposo J, Seixas AC, Vasconcellos FA, Grassmann AA, et al . Highly virulent Leptospira borgpetersenii strain characterized in the hamster model. Am J Trop Med Hyg. 2011;85:271-4. http://dx.doi.org/10.4269/ajtmh.2011.11-0013
44. Matsui M, Rouleau V, Bruyère-Ostells L, Goarant C. Gene expression profiles of immune mediators and histopa- thological findings in animal models of leptospirosis: Comparison between susceptible hamsters and resistant mice. Infect Immun . 2011;79:4480-92. http://dx.doi.org/10.1128/IAI.05727-11
45. Zhang Y, Lou XL, Yang HL, Guo XK, Zhang XY, He P, et al . Establishment of a leptospirosis model in guinea pigs using an epicutaneous inoculations route. BMC Infect Dis. 2012;12:20. http://dx.doi.org/10.1186/1471-2334-12-20
46. Alves V, Siqueira S, Pestana C. Patología da leptospirose. Análise crítica dos aspectos morfológicos e imuno- histoquímicos relevantes para a compreensão da patogenia. Revista do Instituto Adolfo Lutz. 1989;49:75-80.
47. Nicodemo A, Duarte M, Alves V, Takakura C, Santos R, Nicodemo EL. Lung lesions in human leptospirosis: Microscopic, immunohistochemical, and ultrastructural features related to thrombocytopenia. Am J Trop Med Hyg. 1997;56:181-7.
48. Marchiori E, Lourenco S, Setúbal S, Zanetti G, Gasparetto T, Hochhegger B. Clinical and imaging manifestations of hemorrhagic pulmonary leptospirosis: A state-of-the- art review. Lung. 2011;189:1-9. http://dx.doi.org/10.1007/s00408-010-9273-0
49. Croda J, Neto A, Brasil A, Pagliari C, Nicodemo A, Duarte M. Leptospirosis pulmonary haemorrhage syndrome is associated with linear deposition of immunoglobulin and complement on the alveolar surface. Clin Microbiol Infect. 2010;16:593-9. http://dx.doi.org/10.1111/j.1469-0691.2009.02916.x
50. Chou LF, Chen YT, Lu CW, Ko YC, Tang CY, Pan MJ, et al . Sequence of Leptospira santarosai serovar Shermani genome and prediction of virulence-associated genes. Gene. 2012;511:364-70. http://dx.doi.org/10.1016/j.gene.2012.09.074