ARTÍCULO ORIGINAL
doi: http://dx.doi.org/10.7705/biomedica.v34i4.2163
1 Unidad Neonatal, Departamento de Pediatría, Hospital Universitario de Santander, Departamento de Pediatría, Escuela de Medicina, Universidad Industrial de Santander, Bucaramanga, Colombia
2 Programa de Especialización en Pediatría, Departamento de Pediatría, Facultad de Medicina, Universidad Nacional de Colombia, Bogotá, D.C., Colombia
3 Programa de Especialización en Pediatría, Departamento de Pediatría, Escuela de Medicina, Universidad Industrial de Santander, Bucaramanga, Colombia
4 Departamento de Pediatría, Escuela de Medicina, Universidad Industrial de Santander, Bucaramanga, Colombia
5 Departamento de Ginecobstetricia, Escuela de Medicina, Universidad Industrial de Santander, Bucaramanga, Colombia
Contribución de los autores:
Luis Alfonso Pérez: dirección del proyecto, diseño del estudio y análisis de los datos
Diana Marcela González: diseño del estudio y captación de pacientes
Karen Margarita de Jesús Álvarez: captación de pacientes
Luis Alfonso Díaz-Martínez: diseño del estudio y control de calidad de los datos
Todos los autores participaron en la interpretación de los datos y la escritura del manuscrito.
Recibido: 17/10/13; aceptado: 25/08/14
Introducción. La presión positiva continua en la vía aérea ( Continuous Positive Airway Pressure , CPAP) es útil en prematuros de 28 a 32 semanas de gestación con síndrome de dificultad respiratoria, pero no se ha precisado si es mejor que la respiración mecánica asistida después de la administración precoz de surfactante pulmonar.
Objetivo. Comparar la incidencia de eventos adversos en prematuros de 28 a 32 semanas de gestación con síndrome de dificultad respiratoria atendidos con surfactante y respiración mecánica asistida o CPAP de burbuja.
Materiales y métodos. Se atendieron 147 neonatos con respiración mecánica asistida y 176 con CPAP, ninguno de los cuales presentaba asfixia perinatal o apnea.
Resultados. La incidencia de fracaso de la CPAP fue de 6,5 % (IC 95% 11,3-22,8 %). Fallecieron 29 pacientes, 7 de los cuales habían recibido CPAP (4,0 %) y, 22, respiración mecánica asistida (15,0 %; p<0,001). El riesgo relativo (RR) de morir de quienes recibieron CPAP, comparado con el de quienes recibieron respiración mecánica asistida, fue de 0,27 (IC 95% 0,12-0,61), pero, al ajustar por los factores de confusión, el uso de CPAP no implicó mayor riesgo de morir (RR=0,60; IC 95% 0,29-1,24). La letalidad con respiración mecánica asistida fue de 5,70 (IC 95% 3,75-8,66) muertes por 1.000 días-paciente, mientras que con CPAP fue de 1,37 (IC 95% 0,65-2,88; p<0,001). La incidencia de neumopatía crónica fue menor con CPAP (RR=0,71, IC 95% 0,54-0,96), al igual que la de hemorragia cerebral (RR=0,28; IC 95% 0,09-0,84) y la de sepsis (RR=0,67; IC 95% 0,52-0,86), pero fue similar en cuanto a escapes de aire (RR=2,51; IC 95% 0,83-7,61) y enterocolitis necrosante (RR=1,68; IC 95% 0,59-4,81).
Conclusión. La incidencia de neumopatía crónica, hemorragia ventricular y sepsis es menor con el uso de CPAP.
Palabras clave: síndrome de dificultad respiratoria del recién nacido, respiración con presión positiva, respiración artificial, prematuro, recién nacido de muy bajo peso, surfactantes pulmonares.
doi: http://dx.doi.org/10.7705/biomedica.v34i4.2163
Nasal CPAP versus mechanical ventilation in 28 to 32-week preterm infants with early surfactant administration
Introduction: Continuous positive airway pressure (CPAP) is useful in low birth weight infants with respiratory distress, but it is not known if it is a better alternative to mechanical ventilation after early pulmonary surfactant administration.
Objective: To compare the incidence of adverse events in 28 to 32-week newborns with respiratory distress managed with mechanical ventilation or CPAP after early surfactant administration.
Materials and methods: In total, 176 newborns were treated with CPAP and 147 with mechanical ventilation, all with Apgar scores >3 at five minutes and without apnea.
Results: The incidence of CPAP failure was 6.5% (95% CI: 11.3-22.8%); 29 patients died: 7 with CPAP (4.0%) and 22 with mechanical ventilation (15.0%, p<0.001). The relative risk of dying with CPAP versus mechanical ventilation was 0.27 (95% CI: 0.12-0.61), but after adjusting for confounding factors, CPAP use did not imply a higher risk of dying (RR=0.60; 95% CI: 0.29-1.24). Mechanical ventilation fatality rate was 5.70 (95% CI: 3.75-8.66) deaths/1,000 days-patient, while with CPAP it was 1.37 (95% CI: 0.65-2.88, p<0.001). Chronic lung disease incidence was lower with CPAP than with mechanical ventilation (RR=0.71; 95% CI: 0.54-0.96), as were intracranial hemorrhage (RR=0.28, 95% CI: 0.09-0.84) and sepsis (RR=0.67; 95%CI: 0.52-0.86), and it was similar for air leaks (RR=2.51; 95% CI: 0.83-7.61) and necrotizing enterocolitis (RR=1.68, 95% CI: 0.59-4.81).
Conclusion: CPAP exposure of premature infants with respiratory distress syndrome is protective against chronic lung disease, intraventricular hemorrhage and sepsis compared to mechanical ventilation. No differences were observed regarding air leak syndrome or death.
Key words: Respiratory distress syndrome, newborn; positive-pressure respiration; respiration, artificial; infant, premature; infant, very low birth weight; pulmonary surfactants.
doi: http://dx.doi.org/10.7705/biomedica.v34i4.2163
El déficit de surfactante pulmonar es el problema respiratorio más frecuente que presentan los recién nacidos prematuros, y el apoyo respiratorio que se utilice influye en el resultado final, especialmente en la gravedad de la displasia broncopulmonar (1). En los últimos años se ha acumulado evidencia sobre cómo el apoyo respiratorio con presión positiva continua en la vía aérea ( Continuous Positive Airway Pressure , CPAP), comparado con el uso de la respiración mecánica asistida conven cional, es una alternativa eficaz, no invasiva y de bajo costo que, además, presenta cada vez menos complicaciones, por lo que su uso es cada vez más frecuente para reducir la displasia broncopulmonar, particularmente en países con recursos económicos limitados (2,3).
En los meta-análisis publicados en los últimos años, que incluyen gran cantidad de estudios sobre intervenciones sin uso de surfactante, se concluye que: la CPAP reduce el tiempo de intervención de la enfermedad de membrana hialina; que es equivalente a la respiración mecánica en cuanto a mortalidad, presencia de enterocolitis necrosante y hemorragia intraventricular (con la ventaja de que puede usarse incluso en prematuros muy pequeños), y que la gravedad de la displasia broncopulmonar es menor, por lo que también se reduce el uso de oxígeno y esteroides (1,2,4-8).
La administración endotraqueal precoz de surfactante pulmonar es otra estrategia de manejo del problema respiratorio de los prematuros cuando se intenta compensar el déficit del surfactante natural, causa primaria de la enfermedad (1). Aunque el efecto de la administración del surfactante es positivo, en muchos pacientes sigue siendo necesaria la asistencia respiratoria, ya sea con CPAP o con respiración mecánica asistida. Sin embargo, los ensayos clínicos y meta-análisis publicados hasta el momento no incluyen el efecto que tiene la aplicación de surfactante pulmonar en los resultados cuando se comparan la CPAP y la respiración mecánica asistida. Se encuentran estudios en los que se compara la CPAP sin administración de surfactante y la respiración mecánica asistida con surfactante, pero no así estudios que comparen estas dos estrategias empleadas con surfactante, por lo que existe la necesidad de llevarlos a cabo (2,4-8), objetivo al que se abocó el presente estudio de cohorte.
En este artículo se presenta la evaluación retros pectiva de los resultados clínicos en una cohorte de recién nacidos prematuros de 28 a 32 semanas de gestación, con déficit de surfactante, a quienes se les administró surfactante, así como respiración mecánica asistida o CPAP de forma inmediata.
Materiales y métodos
Tipo de estudio
Se llevó a cabo un estudio retrospectivo de cohorte con neonatos prematuros de 28 a 32 semanas de gestación con déficit de surfactante, nacidos en el Hospital Universitario de Santander, Bucaramanga , Colombia, entre enero de 2005 y diciembre de 2011.
En dicho hospital, todo neonato prematuro con la mencionada edad de gestación recibe surfactante en la primera hora de vida si su déficit es evidente por presentar síndrome de dificultad respiratoria. Sin embargo, debido a cuestiones de disponibilidad de cupos, e independientemente de su edad de gestación o estado clínico, los neonatos pueden ser trasladados a cualquiera de dos servicios: la unidad neonatal o la unidad de cuidados intensivos pediátricos, la cual es mixta, ya que allí se atiende tanto población pediátrica como neonatal. En la unidad neonatal, para el manejo inicial de la dificultad respiratoria se administra surfactante y siempre se usa CPAP de burbuja y no respiración mecánica asistida, en tanto que en la unidad de cuidados intensivos pediátricos siempre se emplea respiración mecánica asistida después del surfactante. La decisión de enviar a un neonato a una u otra unidad depende de la disponibilidad de cupos en cada uno de estos servicios.
Dado que el manejo de la dificultad respiratoria con soporte respiratorio es distinto en las dos dependencias, la situación administrativa permite comparar los resultados de las dos intervenciones en los primeros 30 días de vida, la incidencia acu mulada y la tasa de muerte, sepsis, escapes de aire, neumopatía crónica, enterocolitis necrosante y hemorragia intraventricular.
Atención inicial neonatal y administración de surfactante
En el momento del nacimiento, en sala de partos o en quirófanos, todos los niños son atendidos por el mismo personal médico y paramédico entrenado con base en el protocolo de reanimación neonatal de la American Academy of Pediatrics (9). Como conducta institucional, a los recién nacidos de 28 a 32 semanas de gestación, que presenten dificultad respiratoria y buen esfuerzo respiratorio, se les suministra CPAP con una fracción de oxígen o inspirada ( Fraction of Inspired Oxygen , FiO 2 ) de 40 %, administrada con Neopuff™ (Fisher and Paykel Healthcare, Inc., Auckland, Nueva Zelanda); poste riormente, se ajusta la FiO 2 según la oximetría de pulso para mantener la saturación entre 88 y 92 %.
Se procede, entonces, a administrar surfactante pulmonar, principalmente surfactante natural de origen bovino (Survanta ® ). La técnica de admi nistración del surfactante en los pacientes que van a ser manejados con CPAP de burbuja en la unidad neonatal, se conoce como INSURE, y se hace con intubación orotraqueal, aplicación del surfactante, retiro del tubo y nueva administración de CPAP con Neopuff™ . Todo el procedimiento se lleva a cabo bajo sedación con midazolam (dosis de 0,1 a 0,2 mg/kg por vía intravenosa).
En el caso de la administración de surfactante, se corrobora la posición adecuada del tubo endotraqueal verificando la simetría de la excur sión torácica, la medición del tubo según las indicaciones de la American Academy of Pediatrics y la auscultación de ruidos respiratorios simétricos; una vez se han verificado estos aspectos, y bajo control no invasivo, se instila lentamente en la vía aérea el surfactante pulmonar (100 mg/kg) en dos alícuotas con dos minutos de diferencia entre ellas. Al finalizar el procedimiento, y después de comprobar la respiración espontánea, se retira el tubo y, con ayuda del Neopuff™, se suministra CPAP con mascarilla de 5 cm de H 2 O; después se traslada el paciente a la unidad neonatal, donde se instala la CPAP de burbuja.
Los pacientes admitidos en la unidad de cuidados intensivos pediátricos se trasladan intubados des pués de la administración de surfactante. Allí se instala un respirador sincronizado, la mayoría de las veces con una presión inspiratoria máxima ( Peak Inspiratory Pressure , PIP) de 20 cm de agua y una presión espiratoria final máxima ( Peak End Expiratory Pressure , PEEP) de 5 cm de agua, con tiempo inspiratorio de 0,25 . Los parámetros se modifican según los gases arteriales, los hallazgos clínicos y los que brinda el respirador.
Protocolos de asistencia ventilatoria
La CPAP de burbuja se instala con una presión de 4 a 6 cm de H 2 O y una temperatura de humidificación de 39 °C. Este grupo de neonatos recibe uniformemente una dosis inicial de aminofilina de 5 mg/kg por vía intravenosa, seguida de dosis de mantenimiento de 2,5 mg/kg cada 12 horas hasta el momento en que se suspende la CPAP de burbuja.
Se hace el seguimiento de los pacientes hasta que la dificultad respiratoria desaparece y se retira la CPAP de burbuja, o esta falla, caso en que reciben respiración mecánica asistida; los criterios del fracaso de la CPAP son los siguientes: FiO 2 >0,75 durante más de 30 minutos para mantener la saturación entre 88 y 92 %; disminución persistente o recurrente de la saturación por debajo de 80 % que no se deba al manejo de secreciones; respiración con presión positiva mediante mascarilla; acidosis respiratoria (PCO 2 >65 mm Hg y pH <7,22), o presencia de apnea recurrente que requiera reanimación por medio de respiración asistida con presión positiva. Los pacientes que deben recibir respiración mecánica asistida por falla de la CPAP se envían a la unidad de cuidados intensivos pediátricos y se les coloca el respirador con los parámetros iniciales ya descritos, en tanto que las modificaciones subsecuentes dependen del criterio del médico tratante.
Criterios de inclusión y exclusión
Los pacientes evaluados durante el estudio debían cumplir con los siguientes criterios: haber nacido en el Hospital Universitario de Santander entre enero de 2005 y diciembre de 2011, tener una edad de gestación de 28 a 32 semanas según la valora ción obstétrica, presentar déficit de surfactante y haberlo recibido en la primera hora de vida. Se excluyeron aquellos que requirieron intubación durante la reanimación o cuyo puntaje de Apgar a los cinco minutos de vida hubiera sido menor de 3, ya que estos no son candidatos para la aplicación de CPAP.
Resultados evaluados
Estos se ajustaron a las definiciones estándar e incluyeron la presencia de displasia broncopulmonar en los primeros 30 días de vida extrauterina (10), de hemorragia intraventricular (11), enterocolitis necrosante (12), sepsis (13) , e scapes de aire y muerte por cualquier causa. En cuanto al diagnóstico de neumopatía crónica, solo se tuvieron en cuenta los pacientes que sobrevivieron al día 28 de vida.
Análisis estadístico
El análisis se hizo con el paquete Stata/SE™ 12.1 para Windows (StataCorp, College Station, 2013). Se tuvieron en cuenta los diagnósticos consignados por el médico tratante al ingreso en cualquiera de las dos unidades en cuanto a neumonía connatal, taquipnea transitoria, aspiración de meconio y asfixia perinatal. Se analizaron las variables demo- gráficas y clínicas generales de los dos grupos para establecer si eran comparables; en los casos pertinentes, se estimó el intervalo de confianza de 95 % (IC 95% ) o el recorrido intercuartílico (RIC). Las diferencias se evaluaron mediante las pruebas de ji al cuadrado, de Fischer o de McNemar según la situación, asumiendo como significativas aquellas diferencias con a<0,05.
La incidencia acumulada de los resultados en los primeros 30 días de vida se analizó mediante el riesgo relativo (RR) que representa la CPAP como intervención evaluada, y el IC 95% . Las variables independientes asociadas con cada resultado, o que tuvieran un a<0,20, se incluyeron en un modelo multivariado binomial, siempre y cuando no fueran colineales ni estratos heterogéneos en la incidencia del resultado evaluado, y que representaran posibles situaciones de confusión del efecto implícitas en el uso de la CPAP. La heterogeneidad de los estratos se evaluó mediante la prueba de Woolf, en la cual se espera un a>0,05 para que los estratos se consideren homogéneos. Si esto ocurre, dichas variables pueden incluirse en los modelos multivariados y no es necesario estudiar cada estrato como una población diferente (14).
Además, la mortalidad se evaluó también como tasa de incidencia (o densidad de incidencia) cada 1.000 días/persona, a partir de lo cual se estimó la razón relativa de tasa ( Incidence-Rate Ratio , IRR), análisis que igualmente se ajustó mediante regresión de Cox debido a la potencial confusión de los cofactores y siguiendo los mismos principios de inclusión en el modelo, con el fin de estimar la razón de riesgos ( Hazard Ratio , HR). Como complemento de este análisis de mortalidad, se estimaron curvas de supervivencia de Kaplan-Meier, las cuales se compararon con la prueba de Mantel-Cox.
Consideraciones éticas
El proyecto fue aprobado por el Comité de Ética en Investigación de la Universidad Industrial de Santander.
Resultados
Características de la población estudiada
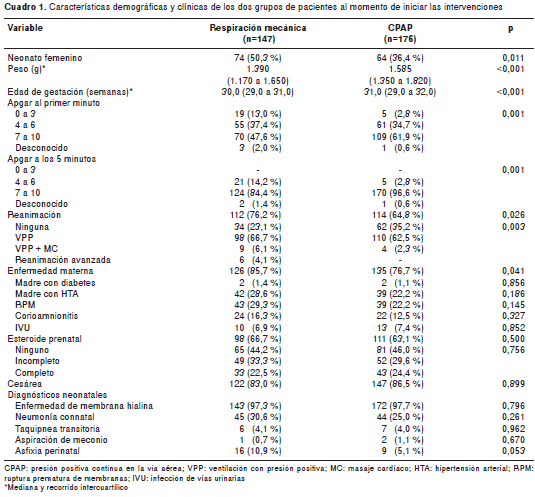
Se revisaron 323 historias clínicas de prematuros atendidos en el Hospital Universitario de Santander entre 2005 y 2011, que cumplían con los criterios de inclusión; 147 (45,5 % ) de ellos habían recibido inicialmente respiración mecánica asistida y surfactante y, 176 (54,5 %), CPAP y surfactante.
Se encontró una mayor proporción de niñas en el grupo de respiración mecánica asistida (50,3 %) que en el de CPAP (36,4 %, p=0,011) (cuadro1) , así como diferencias significativas respecto al peso al nacer, con una diferencia promedio entre los dos grupos de 184 g (IC 95% 106 a 263) y en la edad de gestación (diferencia promedio de 0,82 semanas, IC 95% 0,52 a 1,11). Las niñas tuvieron menor peso que los niños, con una diferencia promedio de 132 g (IC 95% 51 a 212) a favor de los varones (p=0,001).

El puntaje de Apgar en el primer minuto y a los cinco minutos fue inferior en el grupo de respiración mecánica asistida; no se encontraron pacientes con puntaje de Apgar de 3 o menos a los cinco minutos, ni que hubieran requerido intubación durante la reanimación, lo cual era uno de los criterios de exclusión. La prevalencia de un puntaje adecuado de Apgar (7 a 10 puntos) en el primer minuto y a los cinco minutos fue similar entre niños y niñas: 59,5 % Vs . 50,0 % (p=0,404 ) en el primer minuto, y 93,5 % Vs. 89,9 % (p=0,468) a los cinco minutos.
Con respecto a las enfermedades maternas, se encontró una diferencia significativa en la presencia de alguna enfermedad materna en los dos grupos (85,7 % en el de respiración mecánica asistida Vs . 76,7 % en el de CPAP; p=0,041 ); sin embargo, no hubo diferencias en el diagnóstico de ninguna de las condiciones específicas estudiadas. Entre las enfermedades neonatales, solo la impresión diagnóstica inicial de asfixia perinatal fue mayor en el grupo de respiración mecánica asistida, diferencia que se ubicó en el límite de la significancia (p=0,053).
Éxito de la presión positiva continua en la vía aérea y mortalidad por intervención
De los 176 pacientes atendidos inicialmente con CPAP , en 147 se resolvió el problema de dificultad respiratoria, lo que significó una incidencia acumulada de fracaso de la CPAP de 16,5 % (IC 95% 11,3 a 22,8 %); todos estos pacientes recibieron respiración mecánica asistida, además de otro paciente en quien no hubo fracaso de la CPAP, pero que presentó neumotórax espontáneo 48 horas después de habérsele retirado la CPAP.
Fallecieron 29 pacientes en los primeros 30 días de vida extrauterina, 7 en el grupo de CPAP (incidencia acumulada de 4,0 %; IC 95% 1,6 a 8,0 %) y 22 entre los atendidos con respiración mecánica asistida (incidencia acumulada de 15,0 %; IC 95% 9,6 a 21,8 %); estas diferencias fueron significativas ( p<0,001 ), y el riesgo relativo crudo de morir habiendo recibido CPAP, comparado con el de haber recibido respiración, fue de 0,266 (IC 95% 0,117 a 0,605). En el grupo de CPAP se produjeron tres muertes más después del primer mes de vida extrauterina, lo que aumentó la mortalidad acumulada, sin que esto signifique que las diferencias hayan sido producto del azar, al punto de que, incluso al incluir a estos pacientes fallecidos, el uso de la CPAP, comparado con el de la respiración mecánica asistida, resultó en una reducción del riesgo de 62,0 % (IC 95% 22,4 a 81,4 %), dado un riesgo relativo crudo de morir de 0,380 (IC 95% 0,186 a 0,776).
Puesto que había diferencia entre los dos grupos en cuanto a algunas variables que hubieran podido influir en el riesgo de muerte, se hizo un análisis estratificado según las consideraciones planteadas en la metodología y no se encontraron estratos heterogéneos en la asociación de la mortalidad con el uso de CPAP, comparada con la respiración mecánica asistida (cuadro2). De esta manera, se pudo construir el modelo binomial para establecer la fuerza de asociación entre el uso de la CPAP y el riesgo de muerte en los 30 primeros días de vida, modelo en el que se incluyó el sexo del paciente.
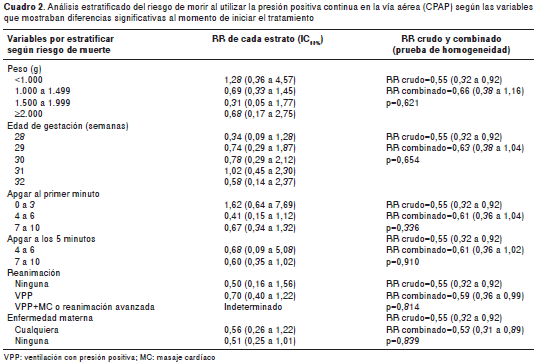
Así, el uso de la CPAP no implicó un menor riesgo acumulado de morir en los primeros 30 días de vida (RR=0,60; IC 95% 0 ,29 a 1,24), mientras que fueron factores protectores un mayor puntaje de Apgar en el primer minuto de vida (RR=0,46; IC 95% 0,21 a 0,99 para un puntaje de 4 a 6; y RR=0,41; IC 95% 0,17 a 0,98 para un puntaje de 7 a 10); el peso al nacer (RR=0,46; IC 95% 0,21 a 0,99 para los neonatos de 1.000 a 1.499 g; RR=0,14; IC 95% 0,05 a 0,43 para los neonatos de 1.500 a 1.999 g; y RR=0,28; IC 95% , 0,06 a 1,24 para los de 2.000 o más g), y la presencia de cualquier enfermedad materna (RR=0,34; IC 95% 0,21 a 0,57). El Apgar a los cinco minutos no se incluyó en el modelo simultáneamente con el del primer minuto, pues habrían sido colineales; cuando el Apgar a los cinco minutos se incluyó en el modelo sin el del primer minuto, tanto este como las otras variables mostraron prácticamente la misma fuerza de asociación.
En términos de la tasa de mortalidad (o densidad de incidencia) en los 30 primeros días de vida, se encontró que la mortalidad entre los pacientes sometidos inicialmente a respiración mecánica asis tida fue de 5,70 muertes (IC 95% 3,75 a 8,66) por cada 1.000 días-paciente, mientras que entre aquellos atendidos con CPAP fue de 1,37 muertes (IC 95% 0,65 a 2,88) por cada 1.000 días-paciente, diferencia que es significativa (p<0,001). Sin embargo, esta tasa entre los pacientes atendidos con aplicación exitosa de CPAP fue de 0,93 muertes (IC 95% 0,35 a 2,47) por 1.000 días-paciente, mientras que entre aquellos en quienes falló la CPAP, fue de 3,80 (IC 95% 1,22 a 11,77), de tal manera que la diferencia de incidencia entre los dos grupos de CPAP fue significativa (p=0,047), pero no así entre quienes fracasó la CPAP y quienes recibieron respiración mecánica asistida ( 0,272 ); la diferencia entre los que recibieron respiración mecánica asistida y los que recibieron CPAP de forma exitosa, fue significativa (p<0,001) (figura 1).
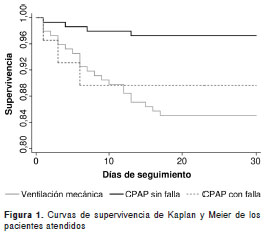
La tasa de mortalidad representa la velocidad a la que se presentan las muertes en los primeros 30 días de vida extrauterina, y fue menor entre los neonatos tratados con CPAP que entre los aten didos con respiración mecánica asistida (HR=0,22; IC 95% 0,07 a 0,71), pero fue mayor cuando la CPAP fracasó ( HR=4,58; IC 95% 1,00 a 20,92 ). Estos datos fueron producto del ajuste por la edad de gestación, el peso al nacer, el uso prenatal de esteroides, una historia materna de hipertensión y la reanimación neonatal.
Tiempo de aplicación de los métodos de soporte respiratorio
En los prematuros sobrevivientes, la diferencia entre el tiempo de uso exitoso de la CPAP y el tiempo de respiración mecánica asistida administrada al inicio, fue estadísticamente significativa (p<0,001) (cuadro 3). Igual ocurrió cuando los bebés fallecidos se incluyeron en este análisis. Por otro lado, los sobrevivientes atendidos infructuosamente con CPAP necesitaron mayor tiempo de respiración mecánica asistida que los que la recibieron inmediatamente (p<0,001), situación que fue la opuesta cuando se consideraron los fallecidos después de recibir una u otra intervención desde el inicio (p<0,001).

Incidencia de la neumopatía crónica
En cuanto al diagnóstico de neumopatía crónica, y luego de excluir en este análisis a los pacientes que fallecieron antes del día 28 de vida (29 en total), se encontró que esta condición se presentó en 38 de 125 (30,4 %) pacientes tratados inicialmente con respiración mecánica asistida y en 30 de 169 (17,8 %) atendidos inicialmente con CPAP, diferencia esta significativa ( p=0,011; RR para CPAP de 0,713; IC 95% 0,539 a 0,956) . Estas diferencias fueron igualmente evidentes cuando se discriminó la neu-mopatía según su gravedad (cuadro 4).
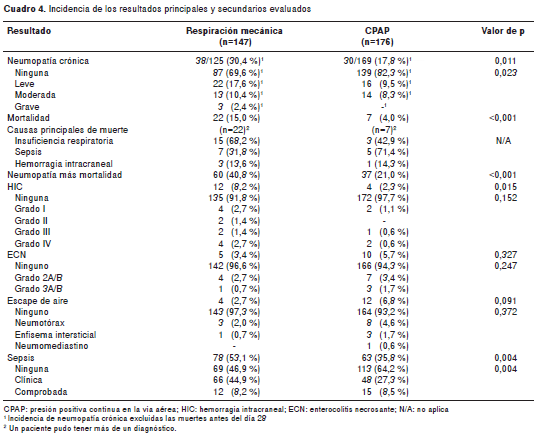
Al agrupar los resultados de la neumopatía crónica y la mortalidad en uno solo, se encontró que se vieron afectados 97 pacientes, 60 (40,8 %) de ellos intervenidos inicialmente con respiración mecánica asistida y 37 (21,0 % ), atendidos con CPAP (p<0,001; RR para CPAP 0,515; IC 95% 0,364 a 0,928).
La asociación entre el riesgo de muerte o neu mopatía crónica y recibir CPAP como primera opción, estuvo en el límite de la significancia a favor de la CPAP (RR=0,74; IC 95% 0,53 a 1,04), lo que sí está asociado con el peso al nacer (RR=0,69; IC 95% 0,53 a 0,91 para los neonatos de 1.000 a 1.499 g; RR=0,16; IC 95% 0,09 a 0,30 para los neonatos de 1.500 a 1.999 g; y RR=0,11; IC 95% 0,03 a 0,43 para los de 2.000 o más g), y con el fracaso de la CPAP (RR=1,57; IC 95% 1,10 a 2,23), todo esto después de ajustar por la necesidad de reanimación, el uso prenatal de esteroides y la edad de gestación.
Otros resultados
En principio, se encontraron diferencias significativas a favor de la CPAP entre los dos grupos de tratamiento en la incidencia de hemorragia cerebral (RR=0,28; IC 95% 0,09 a 0,84) y de sepsis (RR=0,67; IC 95% 0,52 a 0,86), pero no de escapes de aire (RR=2,51; IC 95% 0,83 a 7,61) o de enterocolitis necrosante (RR=1,68; IC 95% 0,59 a 4,81) (cuadro 4). Después de ajustar por el peso al nacer, el uso de esteroides prenatales y el puntaje de Apgar en el primer minuto, la asociación entre el uso de CPAP y la hemorragia cerebral se mantuvo (RR=0,11; IC 95% 0,02 a 0,88), pero, al ajustar por la presencia de sepsis, esta tendió a quedar en el límite de la significancia (RR=0,80; IC 95% 0,61 a 1,05); los otros dos resultados no presentaron asociación con el uso de CPAP.
Discusión
A manera de resumen, los hallazgos de este trabajo permiten plantear que el uso de la CPAP, compa rada con la respiración mecánica asistida, redujo la incidencia de la hemorragia intraventricular, la neumopatía crónica y la sepsis, en los prematuros de 28 a 32 semanas de gestación con dificultad respiratoria.
Las circunstancias administrativas del hospital en donde se realizó este trabajo, permitieron establecer de manera natural dos cohortes de prematuros con cara cterísticas clínicas relativamente similares, que fueron tratados con el mismo protocolo de reanimación al nacer y de administración precoz de surfactante pulmonar, para luego ser enviados a dos servicios clínicos con manejos diferentes en cuanto al posterior soporte respiratorio suministrado. Así, fue posible abordar un interrogante que ha generado controversia en los últimos años: ¿cuál es la mejor opción de tratamiento para los recién nacidos con déficit de surfactante, en quienes la opción de aplicarlo de manera suplementaria implica recurrir al soporte respiratorio con métodos invasivos o con alternativas no invasivas, pues esta conducta influye claramente en los resultados? (1,5,15-24).
Las características demográficas y clínicas de los dos grupos de pacientes no eran estrictamente idénticas y, aunque las diferencias no eran muy acentuadas (por ejemplo, había más varones, hubo más necesidad de reanimación en el grupo que recibió respiración mecánica asistida, y mayor peso y edad de gestación al nacer en el grupo de CPAP), esto obligó a tenerlas en cuenta en el análisis e interpretación de los hallazgos, ya que podían influir en los resultados (1,25).
Esta es quizá la principal debilidad del estudio, pues para resolver de la mejor forma la incertidumbre frente a las dos intervenciones se tendría que haber hecho un ensayo clínico controlado. Un ejemplo de esta debilidad se reflejó en el hecho de que la mortalidad neonatal fue mayor para el sexo masculino, en rangos de edad de gestación y peso al nacer similares (26). Por ello, se tuvo especial cuidado en evaluar si la población bajo estudio representaba diferentes estratos en cuanto a las variables directamente relacion adas con los resultados (sexo, edad de gestación, peso al nacer, puntajes de Apgar, etc.), lo que, en caso de darse, hubiera obligado a tratar a cada uno de tales estratos como poblaciones diferentes imposibles de analizar como si fueran una sola (14). Afortu nadamente, no se encontró estratificación de la población estudiada, por lo que, a pesar de las diferencias intrínsecas debidas a la forma de remitir a los pacientes a cada servicio y, por ende, al tipo de soporte respiratorio administrado, fue posible utilizar un modelo multivariado para ajustar la potencial confusión que podían generar dichas discrepancias en la evaluación de los resultados.
Ahora bien, la incidencia acumulada del fracaso de la CPAP en los pacientes del estudio (16,5 %; IC 95% 11,3 a 22,8 %), fue inferior a la registrada en otros estudios: por un lado, Bohlin (7) informa 19 %, mientras que Ammari, et al. , (27) reportan 24 %; sin embargo, estos últimos atendieron a los pacientes sin administrarles surfactante; en el estudio de Rojas (2), llevado a cabo en Colombia en neonatos tratados con CPAP y surfactante, dicha incidencia fue de 25 %. Esta menor proporción de fracaso correspondió a una duración menor de la CPAP hasta la resolución de la dificultad respiratoria en estos prematuros, comparada con la de la res piración mecánica asistida: 34,0 Vs . 75,8 horas en promedio, respectivamente. Esta reducción de 50 % en el tiempo es un hallazgo relevante en el proceso de atención de estos pacientes, pues los expone menos a los efectos deletéreos de la presión positiva en el tubo orotraqueal (28-31) .
Otros beneficios de la CPAP fueron la menor inci dencia de neumopatía crónica (17,8 Vs . 30,4 %), evaluada sin incluir a los fallecidos en los primeros 28 días de vida, así como la disminución de la gravedad de la displasia en el grupo tratado con CPAP.
Estos resultados se unen a los de muchas otras series citadas en la literatura científica, en las que se ha encontrado que la CPAP disminuye la incidencia de displasia broncopulmonar (3,4,6- 8,18,19,21,24,32,33). En otros estudios no se han encontrado diferencias en la incidencia de la dis plasia broncopulmonar, pero en ninguno de ellos se empleó la misma intervención evaluada en el presente estudio. En el estudio COIN, por ejemplo, se evaluaron 610 neonatos de 25 a 28 semanas asignados a CPAP o respiración mecánica asistida, pero sin administración de surfactante, y se halló que la gravedad de la displasia era menor en el grupo tratado con CPAP; en el estudio IFDAS, cuyo diseño fue similar al del COIN, no se encontraron diferencias en la duración del soporte respiratorio requerido ni en la incidencia de displasia a los 28 días de edad extrauterina o a las 36 semanas de edad de gestación corregida; en el estudio SUPPORT se evaluaron prematuros atendidos con CPAP sin surfactante y con respiración mecánica asistida y surfactante administrado tempranamente , y no se encontraron diferencias en la incidencia de la displasia pero sí en su gravedad (24,34).
Ahora bien, los hallazgos de estos estudios no deben arrojar dudas sobre el hecho de que está ampliamente comprobado que el surfactante juega un papel crucial en la resolución de la dificultad respiratoria. El estudio CURPAP (35), un ensayo clínico europeo multicéntrico con recién nacidos de 25 a 28 semanas de gestación, asignados aleatoriamente a dos esquemas de tratamiento (surfactante profiláctico y CPAP) según dos estratos de edad de gestación, encontró que la necesidad de respiración mecánica asistida en los primeros cinco días de vida extrauterina fue de 32,4 % en quienes recibieron el surfactante, frente a 33,0 % en quienes solo recibieron CPAP ; que la necesidad de respiración mecánica asistida era inversamente proporcional al peso al nacer y mayor en niños que en niñas, y que la incidencia de neumotórax era mayor en el grupo tratado con surfactante profiláctico, comparado con el tratado con CPAP únicamente.
Göpel, et al. , (36), en un ensayo clínico controlado en neonatos de 26 a 28 semanas, con peso menor de 1.500 g, atendidos con CPAP y surfactante cuando se necesitaba una FiO 2 de más de 30 %, o con CPAP sin surfactante, encontraron que la CPAP falló en 35 % de los pacientes sin surfactante y en 26 % de quienes lo recibieron, y que la incidencia de displasia broncopulmonar, así como la de neumotórax, era igualmente menor (8 % Vs . 13 % y 4 % Vs . 7 %, respectivamente).
Por último, en otro ensayo clínico controlado, Tapia, et al., (37) compararon en neonatos de 800 a 1.500 g de peso y con respiración espontánea, la administración de CPAP con surfactante y la de oxígeno con mascarilla o cámara cefálica seguida de respiración mecánica asistida y surfactante en los casos que necesitaran una FiO 2 de más de 35 %, y encontraron que la necesidad de respiración mecánica asistida se redujo en el grupo tratado con CPAP y surfactante, comparado con el grupo tratado con oxígeno (29,8 % Vs. 50,4 %), sin que se encontraran diferencias en la incidencia de muerte, neumotórax, displasia broncopulmonar y otras complicaciones, por lo que concluyeron que la CPAP podía ser una herramienta útil en países con recursos económicos limitados.
En las cohortes de prematuros evaluadas en este estudio, también se halló una menor incidencia de hemorragia intraventricular y de sepsis en el grupo tratado con CPAP, comparado con quienes recibieron respiración mecánica asistida; ambos hallazgos podrían relacionarse con el hecho de que la CPAP es un tipo de soporte respiratorio menos invasivo (38).
Por otro lado, no se encontró una diferencia significativa en la incidencia de enterocolitis necrosante, lo que coincide con los hallazgos de otros estudios en poblaciones similares e intervenciones que buscaban el mismo objetivo (5,20,38). Un fenómeno parecido ocurre con la incidencia de escapes de aire, ligera pero no significativamente mayor entre los pacientes tratados con CPAP, lo que se asemeja a lo hallado en el estudio COIN (23), haciendo la salvedad de que en ese estudio el nivel de presión de la CPAP fue de 8 cm de H 2 O , muy superior al utilizado en la unidad neonatal del Hospital Universitario de Santander.
Independientemente de estos hallazgos, lo que sí está por evaluarse es el nivel de presión mínima de la CPAP que garantice la resolución del problema respiratorio sin aumentar el riesgo de que se presente un cuadro de barotrauma. Desde el 2008 se sabe que la incidencia de neumotórax se reduce con el uso temprano de surfactante en neonatos prematuros con síndrome de dificultad respiratoria (2,24).
Un resultado indeseable sería que la estrategia inicial de administrar surfactante y CPAP fracase y no se logre revertir la progresión de la dificultad respiratoria. Una alternativa a este problema es la selección adecuada de los pacientes en los que se pueda anticipar que la estrategia va a funcionar (30). Infortunadamente, en este estudio no fue posible establecer con claridad los factores asociados con tal fracaso, ya que se requiere un número mayor de pacientes para alcanzar el poder estadístico requerido para dicho análisis.
A manera de conclusión, el presente estudio permite plantear que el empleo de la CPAP después de la administración precoz de surfactante pulmonar en prematuros de 28 a 32 semanas de gestación y sin apnea, es una estrategia válida, en la medida en que en más del 80 % de los casos brinda un tratamiento suficiente y de menor duración que la requerida si se aplicara de forma inmediata la respiración mecánica asistida, lo que, además, reduce el riesgo de lesión pulmonar asociado con esta asistencia respiratoria. Esto significa que en muy buena parte de estos pacientes el problema se resuelve con una menor exposición al oxígeno, evitando las consecuencias deletéreas de la respiración mecánica asistida, y disminuyendo la incidencia de hemorragia del sistema nervioso central, la sepsis y la displasia broncopulmonar, sin aumentar el riesgo de escapes de aire.
Es claro, entonces, que este enfoque es muy atractivo, no solo desde la perspectiva clínica sino desde la de la sostenibilidad de los servicios de atención neonatal, ya que el costo de la atención de estos pacientes se reduce, pues la inversión en los equipos de CPAP es considerablemente menor que la requerida para los de respiración mecánica asistida. De todas maneras, es importante tener en cuenta que una parte de estos pacientes necesita esta última, ya que la CPAP no resuelve todos los casos, por lo que deberá contarse con el recurso de la respiración mecánica asistida para atenderlos, así como de estrategias que permitan identificarlos tempranamente.
Los autores manifestamos que no existen conflictos de intereses relacionados con este trabajo de investigación. Parte del trabajo fue uno de los requisitos de grado de Karen Margarita de Jesús Álvarez en la especialización en Pediatría de la Universidad Industrial de Santander.
No se recibió financiación alguna para adelantar la presente investigación.
Correspondencia: Luis Alfonso Pérez, Carrera 30 N° 53-23, apartamento 1002, Bucaramanga, Colombia Teléfono: (316) 468 7905 lperezvera@hotmail.com1. Subiramanian S, Sweet DG. Management of neonatal respiratory distress syndrome. Paediatr Child Health. 2012; 22:518-22. http://dx.doi.org/10.1016/j.paed.2012.08.013
2. Rojas MA, Lozano JM, Rojas MX, Laughon M, Bose CL, Rondon MA, et al . Very early surfactant without mandatory ventilation in premature infants treated with early continuous positive airway pressure: A randomized controlled trial. Pediatrics. 2009;123:137-42. http://dx.doi.org/10.1542/peds.2007-3501
3. Narendran V, Donovan E, Hoath S, Akinbi H, Steichen J, Jobe A. Early bubble CPAP and outcomes in ELBW preterm infants. J Perinatol. 2003;23:195-9. http://dx.doi.org/10.1038/sj.jp.7210904
4. Kamper J. Early nasal continuous positive airway pressure and minimal handling in the treatment of very-low-birth-weight infants. Biol Neonate. 1999;76(Suppl.1):22-8.
5. Hany A, Milner JD, Patel K, Ayman A, El-Mohandes E. Does the experience with the use of nasal continuous positive airway pressure improve over time in extremely low birth weight infants? Pediatrics. 2004;114:697-702. http://dx.doi.org/10.1542/peds.2003-0572-L
6. Kirchner L, Weninger M, Unterasinger L, Birnbacher R, Hayde M, Krepler R, et al . Is the use of early nasal CPAP associated with lower rates of chronic lung disease and retinopathy of prematurity? Nine years of experience with the Vermont Oxford Neonatal Network. J Perinat Med. 2005;33:60-8. http://dx.doi.org/10.1515/JPM.2005.010
7. Verder H, Bohlin K, Kamper J, Lindwall R, Jonsson B. Nasal CPAP and surfactant for treatment of respiratory distress syndrome and prevention of bronchopulmonary dysplasia. Acta Pædiatr. 2009;98:1400-8. http://dx.doi.org/10.1111/j.1651-2227.2009.01413.x
8. Gregory GA, Kitterman JA, Phibbs RH, Tooley WH, Hamilton WK. Treatment of the idiopathic respiratory distress syndrome with continuous positive airway pressure. N Engl J Med. 1971;284:1333-40. http://dx.doi.org/10.1056/NEJM197106172842401
9. American Heart Association, American Academy of Pediatrics. Manual de reanimación neonatal. Quinta edición. México: AHA/APP; 2010. 304 p.
10. Walsh MC, Wilson-Costello D, Zadell A, Newman N, Fanaroff A. Safety, reliability, and validity of a physiologic definition of bronchopulmonary dysplasia. J Perinatol. 2003; 23:451-6. http://dx.doi.org/10.1038/sj.jp.7210963
11. Papile LA, Burstein R, Kaffler H. Incidence and evolution of subependimal and intraventricular hemorrhage: A study of infants with birth weights less than 1,500 gm. J Pediatr. 1978:92:529-34.
12. Walsh MC, Kliegman RM. N ecrotizing enterocolitis: Treat ment based on staging criteria. Pediatr Clin North Am. 1986;33:179-200.
13. Goldstein B, Giroir B, Randolph A, International Consensus Conference on Pediatric Sepsis. International Pediatric Sepsis Consensus Conference: Definitions for sepsis and organ dysfunction in pediatrics. Pediatr Crit Care Med. 2005;6:2-8. http://dx.doi.org/10.1097/01.PCC.0000149131.72248.E6
14. McCullagh P, Nelder JA. Generalized linear models. Second edition . London: Chapman & Hall/CRC; 1989. 532 p.
15. Gostsh F, Romero R, Kusanovic JP, Mazaki-Tovi S, Pineles B, Erez O, et al . The fetal inflammatory response syndrome. Clin Obstet Gynecol. 2007;50:652-83. http://dx.doi.org/10.1097/GRF.0b013e31811ebef6
16. Cornette L. Fetal and neonatal inflammatory response and adverse outcome. Semin Fetal Neonatal Med. 2004;9:459-70. http://dx.doi.org/10.1016/j.siny.2004.08.004
17 . Berger TM, Bachmann II, Adams M, Schubiger G. Impact of improved survival of very low-birth-weight infants on incidence and severity of bronchopulmonary dysplasia. Biol Neonate. 2004;86:124-30. http://dx.doi.org/10.1159/000078953
18. Verder H. Nasal CPAP has become an indispensable part of the primary treatment of newborns with respiratory distress syndrome. Acta Pædiatr. 2007;96:482-4. http://dx.doi.org/10.1111/j.1651-2227.2007.00263.x
19. Patel D, Greenough A. Does nasal CPAP reduce broncho- pulmonary dysplasia (BPD)? Acta Pædiatr. 2008;97:1314-7. http://dx.doi.org/10.1111/j.1651-2227.2008.00931.x
20. Miksch RM, Armbrust S, Pahnke J, Fusch C. Outcome of very low birthweight infants after introducing a new standard regime with the early use of nasal CPAP. Eur J Pediatr. 2008; 167:909-16. http://dx.doi.org/10.1007/s00431-007-0646-1
21. Bhandari A, Bhandari V. Pitfalls, problems, and progress in bronchopulmonary dysplasia. Pediatrics. 2009;123;1562-73. http://dx.doi.org/10.1542/peds.2008-1962
22. Bohlin K, Jonsson B, Gustafsson AS, Blennow M. Continuous positive airway pressure and surfactant. Neonatology. 2008;9 3:309-15. http://dx.doi.org/:10.1159/000121457
23. Hascoet JM, Espagne S, Hamon I. CPAP and the preterm infant: Lessons from the COIN trial and other studies. Early Human Develop. 2008;84:791-3. http://dx.doi.org/10.1016/j.earlhumdev.2008.09.003
24. Stevens TP, Harrington EW, Blennow M, Soll R. Early surfactant administration with brief ventilation vs . selective surfactant and continued mechanical ventilation for preterm infants with or at risk for respiratory distress syndrome. Cochrane Database Syst Rev. 2007;4:CD003063. http://dx.doi.org/10.1002/14651858.CD003063.pub3
25. Stola A, Schulman J, Perlman J. Initiating delivery room stabilization/resuscitation in very low birth weight (VLBW) infants with a FiO 2 less than 100% is feasible. J Perinatol. 2009;29:548-52. http://dx.doi.org/10.1038/jp.2009.34
26. Hübner ME, Ramírez R. Sobrevida, viabilidad y pronóstico del prematuro. Rev Med Chile. 2002;130:931-8. http://dx.doi.org/10.4067/S0034-98872002000800015
27. Ammari A, Suri M, Milisavljevic V, Sahni R, Bateman D, Sanocka U, et al . Variables associated with the early failure of nasal CPAP in very low birth weight infants. J Pediatr. 2005;147:341-7. http://dx.doi.org/10.1016/j.jpeds.2005.04.062
28. Nowadzky T, Pantoja A, Britton JR. Bubble continuous positive airway pressure, a potentially better practice, reduces the use of mechanical ventilation among very low birth weight infants with respiratory distress syndrome. Pediatrics. 2009;123:1534-40. http://dx.doi.org/10.1542/peds.2008-1279
29. Sekar KC, Corff KE. To tube or not to tube babies with respiratory distress sindrome. J Perinatol. 2009;29:S68- S72. http://dx.doi.org/10.1038/jp.2009.28
30. Krediet TG, Kavelaars A, Vreman HJ, Heijnen CJ, van Bel F. Respiratory distress syndrome associated inflammation is related to early but not late peri/intraventricular hemorrhage in preterm infants. J Pediatr. 2006;148:740-6. http://dx.doi.org/10.1016/j.jpeds.2006.01.037
31. Storme L, Truffert P, Rakza T, Lequien P. Pour ou contre une utilisation precóce de la pression positive continue nasale et du surfactant exogène au cours de la maladie des membranes hyalines. Arguments physiopathologiques. Arch Pediatr. 1999 6:549-55. http://dx.doi.org/10.1016/S0929-693X(99)80564-8
32. Ramanathan R, Sardesai S. Lung protective ventilatory strategies in very low birth weight infants. J Perinatol. 2008;28:S41-6. http://dx.doi.org/10.1038/jp.2008.49
33. SUPPORT Study Group of the Eunice Kennedy Shriver NICHD Neonatal Research Network. Early CPAP versus surfactant in extremely preterm infants . N Engl J Med. 2010;362:1970-9. http://dx.doi.org/10.1056/NEJMoa0911783
34. Sandri F, Plavka R, Ancora G, Simeoni U, Stranak Z, Martinelli S, et al . Prophylactic or early selective surfactant combined with nCPAP in very preterm infants. Pediatrics. 2010;125:e1402-9. http://dx.doi.org/10.1542/peds.2009-2131
35. Göpel W, Kribs A, Ziegler A, Laux R, Hoehn T, Wieg C, et al . Avoidance of mechanical ventilation by surfactant treatment of spontaneously breathing preterm infants (AMV): An open-label, randomized, controlled trial. Lancet. 2011;378:1627-34. http://dx.doi.org/10.1016/S0140-6736(11)60986-0
36. Tapia JL, Urzúa S, Bancalari A, Metano J, Torres G, Fabres J, et al . Randomized trial of early bubble continuous positive airway pressure for very low birth weight infants. J Pediatr. 2012;161:75-80.e1. http://dx.doi.org/10.1016/j.jpeds.2011.12.054
37. Aly H. Ventilation without tracheal intubation. Pediatrics. 2009;124;786-9. http://dx.doi.org/10.1542/peds.2009-0256
38. Aly H, Massaro AN, Hammad TA, Narang S, Essers J. Early nasal continuous positive airway pressure and necrotizing enterocolitis in preterm infants. Pediatrics. 2009;124:205-10. http://dx.doi.org/:10.1542/peds.2008-2588