
doi: http://dx.doi.org/10.7705/biomedica.v37i2.3299
PRESENTACIÓN DE CASO
1 Especialización en Medicina Crítica y Cuidados Intensivos, Facultad de Medicina, Universidad CES, Medellín, Colombia
2 Especialización en Medicina Crítica y Cuidados Intensivos, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia
3 Especialización en Neurología Clínica, Hospital General Ciudad Real, Ciudad Real, España
4 Servicio de Neurorradiología, Instituto Neurológico de Colombia, Medellín, Colombia
5 Unidad de Cuidados Intensivos Neurológicos, Instituto Neurológico de Colombia, Medellín, Colombia
Contribución de los autores:
Moisés Torres, Olga Hernández, Ligia Delgado y Natalia Giraldo: búsqueda bibliográfica y redacción del manuscrito
Piedad Urueña y Sergio Franco: descripción de las imágenes
Piedad Urueña y Olga Helena Hernández: revisión final
Recibido: 30/03/16; aceptado: 17/07/16
El síndrome de encefalopatía posterior reversible es una condición que responde a múltiples causas y presenta características clínicas o radiológicas distintivas; los intensivistas y los médicos de urgencias deben conocerlo con el fin de hacer el diagnóstico y ordenar el tratamiento oportuno.
Se presenta un caso fatal de síndrome de encefalopatía posterior reversible, en el cual se determinaron los factores de riesgo relacionados con el resultado final. Un hombre de 60 años sin antecedentes médicos ingresó por urgencias con depresión de la conciencia, convulsiones y tensión arterial elevada. Las imágenes de la tomografía revelaron un hematoma cerebeloso posterior, y las de resonancia magnética mostraron zonas isquémicas, edema vasogénico que se extendía desde los tálamos hacia el tallo cerebral, los pedúnculos cerebelosos medios y la sustancia blanca profunda de los hemisferios cerebelosos, así como zonas de transformación hemorrágica.
A pesar del tratamiento médico y quirúrgico recibido, el paciente falleció. Se determinaron los factores de riesgo que se han descrito como causa de muerte en este síndrome. Este caso demuestra que dicho síndrome puede ocurrir sin que se hayan detectado factores de riesgo desencadenantes y pone en evidencia la necesidad de su reconocimiento temprano para establecer una intervención adecuada y evitar daños o un desenlace fatal. Además, abre el camino a nuevos estudios sobre la propensión a desarrollarlo y las medidas preventivas que pueden adoptarse.
Palabras clave: edema encefálico; sustancia blanca; síndrome de leucoencefalopatía posterior; síndromes de neurotoxicidad; hemorragia cerebral; imagen por resonancia magnética.
doi: http://dx.doi.org/10.7705/biomedica.v37i2.3299
Posterior reversible encephalopathy syndrome: Report of a fatal case and analysis of predictive factors of a poor prognosis
Posterior reversible encephalopathy syndrome is an illness with multiple causes and distinctive clinicalradiological characteristics that should be known by intensivists and emergency room physicians for a timely diagnosis and treatment. A fatal case of posterior reversible encephalopathy syndrome is presented, and the risk factors related to the outcome are identified.
A 60-year-old man without a relevant medical history arrived at the emergency room presenting with depressed consciousness, seizures, and high blood pressure. Tomographic images revealed a posterior cerebellar hematoma. Resonance images showed ischemic zones, vasogenic edema from the thalamus to the brain stem, middle cerebellar peduncles, deep white matter of the cerebral hemispheres, and zones of hemorrhagic transformation. Despite medical-surgical management, the patient died. The risk factors described as the cause of the fatal outcome were identified. This case demonstrates that posterior reversible encephalopathy syndrome can occur without triggering risk factors and highlights the need for early recognition to establish an appropriate intervention to avoid injury or a fatal outcome. Cases of posterior reversible encephalopathy syndrome provide opportunities to investigate the susceptibility for the development of this condition and to establish appropriate preventive measures.
Key words: Brain edema; white matter; posterior leukoencephalopathy syndrome; neurotoxicity syndromes; cerebral hemorrhage; magnetic resonance imaging.
doi: http://dx.doi.org/10.7705/biomedica.v37i2.3299
En 1996, Hinchey, et al., describieron en algunos pacientes hospitalizados por enfermedad aguda, un síndrome reversible caracterizado por cefalea, alteración de la función mental, convulsiones y pérdida de la visión (1); estos hallazgos clínicos se relacionaron con signos de leucoencefalopatía de localización predominantemente cerebral posterior en los estudios de imágenes, por lo cual recibió el nombre de síndrome de leucoencefalopatía posterior reversible (1,2).
La génesis de esta condición aún se desconoce y su fisiopatología es tema de debate. Su aparición se ha relacionado con algunas condiciones clínicas (1,3,4), entre ellas, hipertensión arterial, preeclampsia, enfermedad renal crónica, inmunosupresión producida por medicamentos y enfermedades autoinmunitarias. Gracias a un mayor refinamiento de las imágenes de resonancia magnética, Casey, et al. (5), encontraron ‘hiperintensidades’ simétricas en las imágenes de secuencia de tiempo de relajación transversal (T2) con compromiso de la sustancia blanca, predominantemente en los lóbulos parietal y occipital. Fue a partir de esta descripción que la condición recibió el nombre de síndrome de encefalopatía posterior reversible (Porterior Reversible Encephalopathy Syndrome, PRES). Hoy sabemos que su localización cerebral posterior no es la única, ya que otras áreas, como la sustancia blanca profunda, el tallo cerebral, el cuerpo calloso y los núcleos basales, pueden verse comprometidas (6). La gran mayoría de los casos no son fatales y los pacientes se recuperan en dos o tres semanas, con leves secuelas neurológicas (3,7).
Se reporta aquí un caso de síndrome maligno de encefalopatía posterior reversible en un paciente con antecedentes de tabaquismo y alergia a la penicilina. Se obtuvo un relato detallado de su comportamiento clínico y se tomaron imágenes de tomografía computadorizada y de resonancia magnética de cráneo; además, se hizo una búsqueda de la literatura científica sobre los factores asociados con un desenlace fatal.
Reporte del caso
Día 1. Un hombre de 60 años de edad con antecedentes de tabaquismo y alergia a la penicilina ingresó al servicio de atención primaria con cefalea de inicio agudo e intensidad progresiva, asociada a mareos.
En el momento del ingreso en urgencias, el paciente presentaba tensión arterial de 220/140 mm Hg y tensión arterial media de 167 mm Hg; no se reportaron otros resultados relevantes en el examen físico.
Se le administró inicialmente nitroprusiato de sodio, sin lograr un control óptimo de la tensión arterial.
Estando en observación, el paciente presentó una crisis convulsiva tónico-clónica generalizada de corta duración (menos de un minuto), con relajación del esfínter vesical y desviación de la mirada, y posteriormente, un período corto de confusión, somnolencia y disartria. Se consideró que se trataba de una encefalopatía hipertensiva, por lo cual se le administró, además, tratamiento antihipertensivo con tiazida, enalapril y betabloqueadores orales, tras lo cual se lo remitió a un centro especializado en atención de condiciones neurológicas críticas.
En el momento del ingreso a este centro, el paciente tenía una frecuencia cardiaca de 68 latidos por minuto, tensión arterial de 205/105 mm Hg, tensión arterial media de 155 mm Hg, saturación de 100 %, y frecuencia respiratoria de 17 respiraciones por minuto.
En el examen neurológico se encontró un paciente alerta, orientado, con una puntuación de 15 sobre 15 en la escala de coma de Glasgow (apertura ocular: 4, respuesta verbal: 5, respuesta motora: 6), con pupilas reactivas (3 mm), pares craneanos del II al XII conservados en forma simétrica, fuerza de 5 sobre 5 en las cuatro extremidades, ataxia en el hemicuerpo izquierdo, sensibilidad conservada y reflejos bilaterales normales.
En los exámenes de laboratorio, se encontró compromiso de la función renal (cuadro 1 ), en tanto que en la tomografía computadorizada simple se evidenció un hematoma en el hemisferio cerebeloso derecho de 9,2 ml con compresión del IV ventrículo e hidrocefalia secundaria, además de hipodensidad a nivel de puente (figura 1).

El paciente se remitió a la unidad de cuidados intensivos neurológicos en donde se inició su monitorización invasiva con línea arterial radial, catéter venoso central y sonda vesical; se le hizo evaluación neurológica seriada y manejo médico de la tensión arterial según las guías de la institución (cuadro 2).

Día 2. El paciente presentó deterioro sutil del estado de alerta y paresia del VI par craneal bilateral, por lo cual se decidió hacer una craniectomía descompresiva de la fosa posterior, drenaje del hematoma subdural, corticecotomía cerebelosa y drenaje del hematoma intracerebeloso, procedimiento que se llevó a cabo sin complicaciones.
Después de la cirugía, se siguió atendiendo al paciente en la unidad de cuidados intensivos neorológicos, pues debía continuarse el tratamiento antihipertensivo intravenoso.
Día 3. En las siguientes 24 horas, el deterioro neurológico se agudizó, con somnolencia, bradilalia, bradipsiquia, mayor compromiso bilateral del VI par craneal y ausencia de reflejo nauseoso, con debilidad motora acompañada de cuadriparesia, fuerza de 2 sobre 5, y reflejos profundos exaltados con signo de Babinski bilateral. Por su condición, el paciente requirió intubación endotraqueal y respiración mecánica asistida.
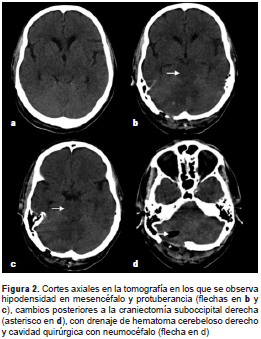
En la tomografía computadorizada de control se observó persistencia de la hipodensidad de la región mesencefálica, así como cambios por la craniectomía suboccipital y el drenaje del hematoma cerebeloso derecho (figura 2). Debido a la persistencia del deterioro clínico, se hizo una resonancia magnética en la cual se encontraron múltiples eventos isquémicos (edema citotóxico) que afectaban especialmente los territorios de ambas arterias cerebrales posteriores y de la arteria cerebral media, y el territorio limítrofe profundo de dichas arterias; la hipodensidad tomográfica en el mesencéfalo y en el puente correspondía a edema vasogénico (figura 3).
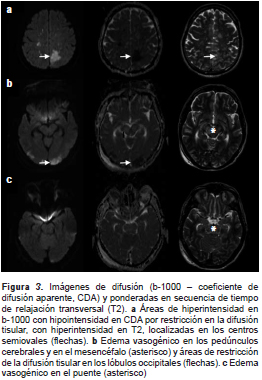
Días 4 y 5. Se continuó la vigilancia hemodinámica y neurológica, y se tomaron medidas para controlar el edema cerebral (tratamiento con agentes osmóticos y sedación profunda); debido a la presencia de un síndrome de reacción inflamatoria sistémica y de bacilos Gram negativos en la secreción traqueal, se inició el tratamiento antibiótico.
Día 6. Se logró estabilizar la tensión arterial del paciente (132/57 mm Hg). En el examen se evidenció apertura ocular en respuesta al estímulo, pupilas reactivas (3 mm), reflejo corneal, reflejo tusígeno débil, y flexión débil de las extremidades.
Se observó un ligero aumento de la creatinina, sin que se cumplieran los criterios para aplicar diálisis.
Se decidió tomar imágenes de las lesiones por resonancia magnética, en las cuales se evidenció un aumento de las zonas isquémicas en ambas arterias cerebrales posteriores y en la arteria cerebral media, así como en el territorio limítrofe profundo de esta, además de edema vasogénico que se extendía hasta la región del núcleo basal, la mesencefálica y el tallo cerebral, y la sustancia blanca profunda de los hemisferios cerebelosos (figura 4).
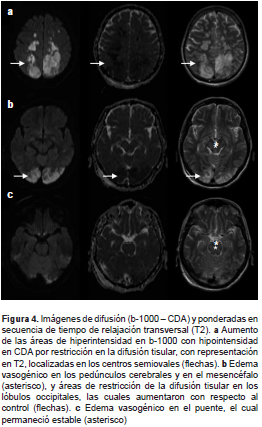
Días 7 a 10. A pesar del manejo médico y quirúrgico, el deterioro clínico del paciente fue en aumento hasta llegar a un estado de mínima conciencia, cuadriparesia y ausencia de reflejos del tallo. Se les explicó a sus familiares la gravedad de la lesión neurológica y, en el día 11, el paciente falleció.
Discusión
Se presenta un caso de síndrome de encefalopatía posterior reversible (PRES) que resultó en la muerte del paciente, lo cual es inusual en esta condición benigna y reversible. El paciente no tenía antecedentes de importancia e ingresó a urgencias por un episodio de hipertensión; de manera incidental, se le detectó enfermedad renal crónica en estadio 3. La descripción de Hinchey, et al. (1), ya destacaba la hipertensión arterial acelerada (urgencia hipertensiva) como causa de este síndrome y se observó que, cuando la hipertensión arterial se presentaba de novo, representaba un factor adicional de riesgo, probablemente por la falta de adaptación de la barrera hematoencefálica a los cambios hemodinámicos del estado hipertensivo; este estado se conoce como falla de la autorregulación cerebral (8).
La autorregulación cerebral se basa en la modificación de la resistencia vascular cerebral (vasodilatación o vasoconstricción cerebral) para garantizar un flujo sanguíneo cerebral que supla las necesidades metabólicas de cada momento. Dicha autorregulación está determinada, en gran medida, por la presión parcial de dióxido de carbono y por la tensión arterial media y, en menor medida, por la presión parcial de oxígeno, la adenosina, el pH, etc.
Su objetivo es obtener una presión de perfusión cerebral que mantenga regulado el flujo sanguíneo cerebral, la cual depende de la tensión arterial media y de la presión intracraneal; se la define como la presión necesaria para perfundir el tejido nervioso y garantizar un buen funcionamiento metabólico. Una presión de perfusión cerebral menor de 50 mm Hg implica una disminución grave del flujo sanguíneo cerebral, con el riesgo de isquemia. Los valores por encima de 60 a 70 y hasta 150 mm Hg se han determinado como seguros en adultos. Cuando se supera este umbral, aparece una vasodilatación cerebral que lleva a la perfusión excesiva con ruptura vascular y edema.
Para frenar este proceso, entra en acción un mecanismo compensatorio que consiste en una vasoconstricción autorreguladora que termina generando edema por hipoxia e isquemia cerebral, con una mayor lesión del tejido cerebral, lo cual se explica por la presencia de enfermedad vascular periférica y un aumento en la producción del factor de crecimiento endotelial vascular como reacción a la hipoxia (6 a 24 horas), que genera la formación de vasos sanguíneos e incremento de la permeabilidad endotelial (9).
Esta hipótesis postula que, a cierto nivel, la hipertensión arterial sobrepasa los límites de autorregulación cerebral, dando paso a un estado de perfusión excesiva que produce edema cerebral vasogénico, lo cual explica los hallazgos en el síndrome de encefalopatía posterior reversible.
En este paciente se presentó la urgencia hipertensiva, pero no tenía antecedentes de hipertensión arterial, por lo cual se postuló que sus mecanismos de autorregulación cerebral se vieron sobrepasados por los altos niveles de tensión arterial, lo cual produjo el edema cerebral cuyo primer signo fue la hemorragia intracraneal.
Hefzy, et al .(10), analizaron 151 casos de pacientes con factores de riesgo descritos para el síndrome de encefalopatía posterior reversible, como la hipertensión arterial, la inmunosupresión posterior a un trasplante o debida a medicamentos, la sepsis y la preeclampsia, entre otros, y reportaron una incidencia de hemorragia cerebral de 15,2 % (23 de 151 pacientes); además, 9 (5,9 %) de los 151 pacientes tenían hipertensión arterial como único signo asociado al síndrome y, de ellos, dos eran hipertensos (22,2 %) y presentaron hemorragia cerebral. Es importante recalcar que estos dos pacientes se catalogaron como hipertensos graves (tensión arterial media >116 mm Hg). En el presente caso hubo, además, hemorragia en la fosa posterior y el registro inicial de la tensión arterial media fue de 155 mm Hg. Por lo tanto, la hipertensión grave detectada de novo fue uno de los factores determinantes en este caso fatal del síndrome.
A pesar del manejo que se le dio, el paciente descrito aquí tuvo una evolución desfavorable, la cual se constató en las imágenes de resonancia magnética. En este mismo sentido, Bartinsky, et al. (6), evaluaron la distribución de las lesiones en las imágenes de 136 pacientes con síndrome de encefalopatía posterior reversible (en 22 se hizo tomografía y, en 114, resonancia magnética), y evidenciaron una distribución del edema vasogénico (focal o confluente) de la sustancia blanca: a nivel occipital y parietal en el 98 % de ellos; en 68 %, en el lóbulo frontal; en 40 %, a nivel temporal y occipital; en 32 %, en el cerebelo; en 13 %, en el tallo cerebral; en 14 %, en los núcleos basales; en 18 %, en la sustancia blanca profunda, y en 10 %, en el cuerpo calloso.
Estos patrones de imágenes se definieron como: 1) edema vasogénico holohemisférico (22,8 %), el cual compromete los lóbulos frontal, parietal y occipital, así como los territorios de las arterias cerebrales anteriores, media y posterior; 2) edema vasogénico del surco frontal superior (27,2 %), el cual afecta principalmente los lóbulos frontales y, en menor grado, los lóbulos parietal y occipital; 3) edema vasogénico parietal y occipital (22,1 %), patrón típico de compromiso de la sustancia blanca a nivel parietal y occipital, y 4) edema vasogénico parcial o asimétrico (27,9 %), el cual es una expresión incompleta de los tres patrones previamente descritos.
Lo anterior indica que las lesiones de este síndrome no son únicas y que, más bien, pueden encontrarse en forma combinada, como en el presente caso, en el cual el edema cerebral holohemisférico evolucionó de edema vasogénico a edema citotóxico con subsecuentes infartos cerebrales, aunque no en el tallo cerebral, en la región del núcleo basal ni en el mesencéfalo, en donde el compromiso correspondía al patrón profundo del síndrome (Deep Brain Reversible Encephalopathy, DBRE).
Según algunas publicaciones, la localización y la distribución del edema pueden determinar la gravedad de la lesión; con base en las imágenes por resonancia magnética de recuperación de inversión atenuada de fluido (Fluid-Attenuated Inversion Recovery, FLAIR), MacKinney, et al. (11), por ejemplo, definieron: los casos leves, como aquellos en los cuales el edema afecta la sustancia blanca cortical y subcortical; los casos moderados, como aquellos en los cuales existe edema confluente que se extiende desde la corteza hasta la sustancia blanca profunda, y los casos graves, como aquellos en los cuales se observa edema confluente que se extiende desde la corteza hasta el ventrículo, o edema o hemorragia, o desplazamiento de la línea media, o herniación, o efecto de masa, o compromiso del cerebelo o del tallo cerebral o los núcleos basales (DBRE). El presente caso se clasificó como grave, lo cual probablemente explica el comportamiento maligno y el desenlace fatal.
Debido a dicho desenlace, se hizo una búsqueda de factores predictores del síndrome de encefalopatía posterior reversible y se encontraron varios que deben tenerse en cuenta en esta condición. Hefzy, et al. (10), reportaron que, a pesar de su usual resultado favorable, dicho síndrome se asocia con una mortalidad de 5 a 15 % de los casos y que la transformación hemorrágica (petequias, hematomas, hemorragia subaracnoidea o hemorragia intraventricular) aumenta la mortalidad a 29 %. En el presente caso, llama la atención la presentación inicial con un hematoma de gran tamaño en el hemisferio cerebeloso derecho, similar al del caso fatal reportado por Macdonnel (12) en un joven de 14 años, que desarrolló hipertensión aguda después de un trasplante renal, y un edema extenso de la sustancia blanca subcortical con hemorragia subaracnoidea, sangrado en el parénquima y hemorragia intraventricular, lo cual, finalmente, resultó en muerte cerebral.
En otro estudio retrospectivo, Alhilali, et al., evaluaron si los datos demográficos y los hallazgos de las imágenes y de laboratorio predecían un desenlace fatal en un grupo de 47 pacientes con síndrome de encefalopatía posterior reversible (13). El análisis multivariado mostró que la urgencia hipertensiva como causa (odds ratio, OR=1,6; IC95% 1,34-1,92), la presencia de hemorragia (OR=4,77; IC95% 3,09-672) y la hipoglucorraquia (OR=1,93; IC95% 1,5-2,48), se relacionaban con la muerte atribuida directamente a los efectos tóxicos del síndrome.
En una cohorte retrospectiva de 70 pacientes con este síndrome, Legriel, et al., analizaron variables clínicas, demográficas y de laboratorio, y usaron la escala de Glasgow para el resultado con el fin de evaluar el estado funcional a los 90 días(14). En el análisis multivariado, encontraron que la hiperglucemia en el momento de la aparición del síndrome (OR=1,22; IC95% 1,02-1,45) y un tiempo de más de 30 minutos entre su inicio y la corrección de la causa (OR=3,3; IC95% 1,04-10,46) se relacionaban con la mortalidad. En el presente caso, se detectaron estos dos factores asociados con un mal pronóstico: hiperglucemia de 175 mg/dl al ingreso y retraso de más de 24 horas en corregir la urgencia hipertensiva.
Conclusiones
En este caso, el síndrome de encefalopatía posterior reversible desembocó en la muerte de un paciente sin factores de riesgo, que presentó hemorragia en la fosa posterior y tensión arterial elevada, aunque no tenía antecedentes de hipertensión arterial.
Entre los factores de riesgo que pueden indicar el curso maligno o el desenlace fatal del síndrome, se encontraron: origen hipertensivo, compromiso holohemisférico, extensa distribución del edema, transformación hemorrágica, hiperglucemia en el momento del ingreso, hipoglucorraquia y retraso en la corrección de la causa aparente (urgencia hipertensiva).
Este caso demuestra que la encefalopatía posterior reversible puede aparecer en pacientes sin factores de riesgo desencadenantes y pone en evidencia la necesidad de su reconocimiento temprano para establecer una intervención adecuada y evitar los daños o la muerte. Además, abre el camino para futuras investigaciones sobre la propensión a desarrollarlo y sobre las medidas preventivas o de tratamiento adecuadas.
Dado que en este síndrome es fundamental determinar la causa e instaurar un tratamiento oportuno para evitar secuelas y un posible desenlace fatal, se propone un esquema de diagnóstico y tratamiento (figura 5).

Consideraciones éticas
Se obtuvo el aval del Comité de ética del Instituto Neurológico de Colombia (INDEC), y el consentimiento informado de los familiares del paciente para la publicación del caso y de las imágenes diagnósticas, con el debido respeto por la privacidad del paciente y de sus familiares, y por la confidencialidad de los datos.Ninguna.
Correspondencia: Olga Helena Hernández, Calle 55 N° 46-36, Medellín, Colombia Teléfono: (320) 698 9432 olgahdezo@gmail.com
1. Hinchey J, Chaves C, Appignani B, Breen J, Pao L, Wang A, et al. A reversible posterior leukoencephalopathy syndrome. N Engl J Med. 1996;334:494-500. http://dx.doi.org/10.1056/NEJM199602223340803
2. Yoshida K, Kamamoto T, Mori K, Maeda M. Reversible posterior leukoencephalopathy syndrome in a patient with hypertensive encephalopathy--case report. Neurol Med Chir. 2001;41:364-9. http://doi.org/10.2176/nmc.41.364
3. Bartynski WS. Posterior reversible encephalopathy syndrome, part 1: Fundamental imaging and clinical features. AJNR Am J Neuroradiol. 2008;29:1036-42. http://doi.org/10.3174/ajnr.A0928
4. Servillo G, Bifulco F, De Robertis E, Piazza O, Striano P, Tortora F, et al. Posterior reversible encephalopathy syndrome in intensive care medicine. Intensive Care Med. 2007;33:230-6. http://doi.org/10.1007/s00134-006-0459-0
5. Casey SO, Sampaio RC, Michel E, Truwit CL. Posterior reversible encephalopathy syndrome: Utility of fluid attenuated inversion recovery MR imaging in the detection of cortical and subcortical lesions. Am J Neuroradiol. 2000;21:1199-206.
6. Rykken JB, McKinney AM. Distinct imaging patterns and lesion distribution in posterior reversible encephalopathy syndrome. Am J Neuroradiol. 2007;28:1320-7. http://doi.org/10.3174/ajnr.A0549
7. Rykken JB, McKinney AM. Posterior reversible encephalopathy syndrome. Semin Ultrasound CT MRI. 2014;35:118-35. http://doi.org/10.1053/j.sult.2013.09.007
8. Bartynski WS. Posterior reversible encephalopathy syndrome, Part 2: Controversies surrounding patho-physiology of vasogenic edema. Am J Neuroradiol. 2008;29:1043-9. http://doi.org/10.3174/ajnr.A0929
9. Rodríguez-Boto G, Rivero-Garvía M, Gutiérrez-González R, Márquez-Rivas J. Basic concepts about brain pathophysiology and intracranial pressure monitoring. Neurologia. 2015;30:16-22. http://doi.org/10.1016/j.nrl.2012.09.002
10. Hefzy HM, Bartynski WS, Boardman JF, Lacomis D. Hemorrhage in posterior reversible encephalopathy syndrome: Imaging and clinical features. Am J Neuroradiol. 2009;30:1371-9. http://doi.org/10.3174/ajnr.A1588
11. McKinney AM, Short J, Truwit CL, McKinney ZJ, Kozak OS, SantaCruz KS, et al. Posterior reversible encephalopathy syndrome: Incidence of atypical regions of involvement and imaging findings. Am J Roentgenol. 2007;189:904-12. http://doi.org/10.2214/AJR.07.2024
12. Martins WA, Marrone LC. Malignant posterior reversible encephalopathy syndrome: A case of posterior irreversible encephalopathy syndrome. J Clin Neurol. 2016;12:236-7. http://doi.org/10.3988/jcn.2016.12.2.236
13. Alhilali LM, Reynolds AR, Fakhran S. A multi-disciplinary model of risk factors for fatal outcome in posterior reversible encephalopathy syndrome. J Neurol Sci. 2014;347:59–65. http://doi.org/10.1016/j.jns.2014.09.019
14. Legriel S, Schraub O, Azoulay E, Hantson P, Magalhaes E, Coquet I, et al. Determinants of recovery from severe posterior reversible encephalopathy syndrome. PLoS One. 2012;7:e44535. http://dx.doi.org/10.1371/journal.pone.0044534