ARTÍCULO ORIGINAL
doi: http://dx.doi.org/10.7705/biomedica.v36i0.2912
1 Centro de Investigaciones Odontológicas, Pontificia Universidad Javeriana, Bogotá, D.C., Colombia
2 Facultad de Ciencias para la Salud, Universidad de Caldas, Manizales, Colombia
3 Unidad de Cirugía de Cabeza y Cuello, Hospital Universitario San Ignacio, Bogotá, D.C., Colombia
4 Departamento de Microbiología, Pontificia Universidad Javeriana, Bogotá, D.C., Colombia
Contribución de los autores:
Alveiro Erira y Leidy Angélica Motta: desarrollo de los aspectos experimentales del estudio, apoyo en la estandarización de las técnicas utilizadas y en el análisis de los resultados
Fredy Gamboa: apoyo en el diseño experimental y el análisis de resultados
Andrés Chala y Andrey Moreno: participación en la selección de los casos incluidos en el estudio, toma de muestras y análisis de resultados
Dabeiba Adriana García: diseño del estudio, coordinación de los aspectos experimentales y participación en el análisis de resultados
Todos los autores participaron en la preparación y la revisión del manuscrito.
Recibido: 23/06/15; aceptado: 22/10/15
Introducción. Uno de los factores de riesgo del carcinoma de células escamosas en la cavidad oral es la infección por el virus del papiloma humano (HPV), cuyas prevalencias dependen de la región geográfica.
Objetivo. Identificar los tipos del virus del papiloma humano más frecuentes en el cáncer de la cavidad bucal, sus niveles de expresión y el estado físico del genoma viral.
Materiales y métodos. Se seleccionaron 46 pacientes que asistían a los servicios de cirugía de cabeza y cuello en Bogotá, Manizales y Bucaramanga. El examen histopatológico de las muestras incluidas en el estudio demostró la presencia de carcinoma de células escamosas en la cavidad oral en todas ellas. Se extrajo el ADN para genotipificar el virus y determinar el estado físico de su genoma, y el ARN para determinar los transcritos virales mediante reacción en cadena de la polimerasa en tiempo real.
Resultados. La prevalencia del virus del papiloma humano en los tumores fue de 21,74% (n=10) y el tipo viral más frecuente fue el HPV-16 (nueve casos). La expresión viral del HPV-16 fue baja (una de 11 copias) y el estado físico predominante fue el mixto (ocho casos), con prevalencia de la disrupción en el sitio de unión de E1 y E2 (2525 a 3720 nucleótidos).
Conclusión. En los pacientes con carcinoma de cavidad oral incluidos en este trabajo, la frecuencia del virus del papiloma humano fue relativamente baja (21,7 %) y el tipo viral más frecuente fue el HPV-16, el cual se encontró en forma mixta y con baja expresión de E7 , lo cual puede ser indicativo de un mal pronóstico para el paciente.
Palabras clave: papiloma, orofaringe, carcinoma, integración viral, proteínas oncogénicas, virus tumorales de ADN.
doi: http://dx.doi.org/10.7705/biomedica.v36i0.2912
Genotyping, levels of expression and physical status of human papilloma virus in oropharyngeal squamous cell carcinoma among Colombian patients
Introduction: One of the risk factors for squamous cell oropharyngeal carcinoma is infection with the human papilloma virus (HPV), with prevalences that vary depending on the geographical region.
Objective: To identify the most frequent HPV viral types in oropharyngeal cancer, the levels of expression and the physical condition of the viral genome.
Materials and methods: Forty-six patients were included in the study from among those attending head and neck surgical services in the cities of Bogotá, Manizales and Bucaramanga. In the histopathological report all study samples were characterized as oropharyngeal squamous cell carcinoma. DNA extraction was subsequently performed for HPV genotyping and to determine the physical state of the viral genome, as well as RNA to determine viral transcripts using real-time PCR.
Results: HPV prevalence in tumors was 21.74% (n=10) and the most common viral type was HPV-16 (nine cases). Viral expression for HPV-16 was low (one of 11 copies) and the predominant physical state of the virus was mixed (eight cases), with disruption observed at the E1 - E2 binding site (2525 – 3720 nucleotides).
Conclusion: The prevalence of HPV associated with oropharyngeal carcinoma among the Colombian study population was 21.7%, which is relatively low. The most frequent viral type was HPV-16, found in a mixed form and with low expression of E7 , possibly indicating a poor prognosis for these patients.
Key words: Papiloma, oropharynx, carcinoma, virus integration, oncogene proteins, DNA tumor viruses.
doi: http://dx.doi.org/10.7705/biomedica.v36i0.2912
El carcinoma de células escamosas representa más de 90 % de todos los tumores malignos de la cavidad oral (1), la cual tiene un epitelio poliestratificado de tipo escamoso no ´queratinizado´ y constituye una parte integral de las vías superiores respiratorias y digestivas (2).
En el 2008 se reportaron en el mundo 85.000 nuevos casos de este carcinoma, de los cuales más de tres cuartas partes se presentaron en hombres (3). En el 2012 se reportó un incremento en la incidencia de este cáncer en Estados Unidos, atribuido principalmente a la infección por el virus del papiloma humano (HPV). La incidencia del cáncer de células escamosas en la cavidad oral asociado a este virus aumentó de 0,8 a 2,6 por cada 100.000 habitantes entre 1988 y 2004, mientras que los pacientes negativos para la infección por este virus disminuyeron de 2,0 a 1 por cada 100.000 habitantes (4).
En algunos estudios en Colombia se ha reportado una incidencia de cáncer de cabeza y cuello en hombres y mujeres de 1 y 0,3 por cada 100.000 habitantes respectivamente (5,6). Sin embargo, se desconoce la incidencia del HPV en el cáncer de células escamosas en la cavidad oral en nuestro país. Se ha comprobado que la infección por el HPV es un factor de riesgo del cáncer oral, y que afecta particularmente las amígdalas (hasta 75 % con respecto a otros sitios anatómicos de la cavidad oral) (1,7). En el 2004, Hafkamp, et al., sugirieron que el tropismo viral por esta localización anatómica se explicaría por las características de mucosa de transición de la cavidad oral, predominantemente en el tejido amigdalino, y su gran similitud histológica con la mucosa cervical (8).
La incidencia del cáncer de células escamosas en la cavidad oral inducido por HPV aumenta cada año, con tasas de prevalencia que fluctúan entre 36 y 80 %, dependiendo de la ubicación geográfica y la región anatómica (9-12). En Colombia solo se ha publicado el estudio sobre cáncer de cabeza y cuello asociado a HPV llevado a cabo por Quintero, et al. , en el cual se registró una prevalencia de HPV de 18,9 % (13). Este virus presenta más de 100 tipos virales y, aproximadamente, 40 genotipos se han asociado hasta la fecha con las infecciones anales y genitales; estos tipos de HPV se dividen, a su vez, en tres grupos según su asociación epidemiológica con el cáncer: tipos de alto riesgo: 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68, 73, y 82; posiblemente de alto riesgo: 26, 53 y 66, y de bajo riesgo: 6, 11, 40, 42, 43, 44 y 70 (14-16). El genotipo de HPV encontrado con mayor frecuencia en el cáncer de células escamosas en la cavidad oral en todo el mundo, es el HPV-16 (12,17,18).
Los procesos de carcinogénesis asociados a HPV son promovidos por los genes virales E6 y E7 , ya que inhiben la acción de genes supresores de tumores como el p53 y el pRB, inducen la proliferación celular e inhiben la apoptosis (3). Los genes virales E6 y E7 son regulados negativamente por los genes virales E1 y E2 , los cuales pueden fragmentarse ocasionalmente, lo cual produce la pérdida de control de la transcripción de las oncoproteínas E6 y E7 (19,20). Estos genes provocan la integración del genoma viral al ADN de las células del huésped, incrementando de esta forma la persistencia viral, mecanismo que opera principalmente en virus de alto riesgo (21,22). El ADN del HPV puede darse dentro de la célula humana de tres formas: integrado al genoma celular; libre en el núcleo celular, es decir, en forma episómica, y de forma mixta, es decir, integrada y episómica (21,23).
En este contexto, el presente estudio se propuso identificar los tipos de HPV, principalmente los asociados al desarrollo del cáncer de células escamosas en la cavidad oral, clasificados como virus de alto riesgo, y, además, determinar otros factores virales involucrados, como la expresión de E7 y el estado físico del genoma viral, los cuales podrían favorecer el desarrollo de este tipo de tumor.
Materiales y métodos
Este fue un estudio multicéntrico, descriptivo y de corte transversal, llevado a cabo en Bogotá, Manizales y Bucaramanga. La muestra se seleccionó mediante un muestreo no probabilístico a conveniencia entre 2013 y 2014. Se incluyeron pacientes con diagnóstico clínico de carcinoma de cavidad oral por el cirujano de cabeza y cuello y en espera de ser sometidos a cirugía.
Antes de la intervención quirúrgica, los pacientes incluidos firmaron el consentimiento informado y respondieron una encuesta epidemiológica, documentos que fueron aprobados por el Comité de Ética de la Pontificia Universidad Javeriana.
Después de la toma de la muestra de tejido tumoral, este se dividió en dos fragmentos, uno para el estudio histopatológico con el fin de confirmar el diagnóstico, y el otro se conservó en RNA later ® para su procesamiento posterior. La extracción de ADN y ARN se hizo con el kit AllPrep DNA/RNA/ ProteinQuiagen ® , siguiendo las instrucciones del fabricante.
Genotipificación del HPV
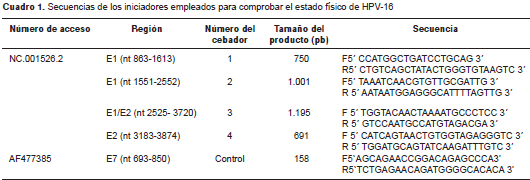
La genotipificación del HPV se hizo con el kit Multimetrix Multiplex HPV Genotyping RVO ® . Inicialmente, se amplificó la región L1 del HPV mediante una reacción en cadena de la polimerasa (PCR) múltiple que contenía nueve cebadores sentido y tres antisentido ´biotinilados´, y para evaluar la calidad del ADN, se incluyó un par de cebadores para amplificar el gen de ß-globina; en este caso, el cebador antisentido también estaba ´biotinilado´. Posteriormente, se hizo la hibridación de los productos de PCR desnaturalizados para su conversión en microesferas que detectan 24 tipos virales: seis de bajo riego (6, 11, 42, 43, 44 y 70), 15 de alto riesgo (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68, 73 y 82) y tres posiblemente de alto riesgo (26, 53 y 66). Para evidenciar la hibridación se añadieron el conjugado y el sustrato y, finalmente, las lecturas se hicieron en el equipo Luminex 100 ® bajo las condiciones sugeridas por el fabricante.
Expresión de la región E7 del HPV-16
Se diseñaron cebadores específicos para la región E7 (693 a 850 nucleótidos) del HPV-16 mediante el programa Primer3 y se corroboraron mediante alineamiento con el programa Basic Local Alignment Search Tool (BLAST). El cebador sentido para el HPV-16 fue 5`AGCAGAACCGGACAGAGCCCA3´ y el antisentido fue 5`TCTGAGAACAGATGGGG CACACA3´. Se construyó una curva estándar para la cuantificación absoluta mediante PCR en tiempo real, utilizando ADN del plásmido de HPV-16 (donado por el doctor zur Hausen, del Deutsches Krebsforschungszentrum - DKFZ, Alemania). Las diluciones del plásmido se hicieron por triplicado en base 10 a partir de un millón de copias hasta una copia, utilizando el compuesto Sybr Green, según la metodología descrita por Montalvo, et al., en el 2009 (24).
El ARN total extraído de cada muestra positiva para HPV-16 fue tratado con DNAsa I (Invitrogen ® ) y la síntesis del ADN complementario (ADNc) se hizo con el kit SuperScript ® III Reverse Transcriptase (Invitrogen), siguiendo las recomendaciones de los fabricantes. Una vez obtenido el ADNc, se hizo la PCR en tiempo real por triplicado para cada muestra con 500 ng de ADNc y con el kit (KAPA SYBR ® FAST qPCR). Como control positivo se utilizó ADN de la línea celular SiHa y, como control negativo, agua. Los niveles de expresión de las muestras se calcularon con base en los resultados de la curva estándar.
Las condiciones de la PCR fueron las siguientes: Master mix 1X, 10 nM de cebadores con un volumen final de 10 µl, y los siguientes ciclos: uno inicial a 95 °C durante tres minutos, 35 ciclos a 95 °C durante tres segundos y a 62 °C durante 30 segundos, tiempo en el cual se detectó la fluorescencia. Por último, se realizó una curva de fusión a 0,5 °C a partir de 65 °C y hasta 95 °C, con lecturas cada 0,5 segundos en un equipo CFX96 ® de Biorad.
Estado físico del HPV-16
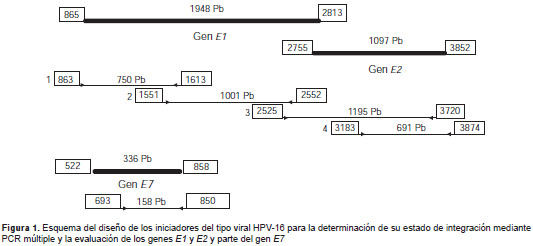
Se diseñaron cebadores para los genes E1 y E2 con zonas superpuestas que cubrían la secuencia completa de los dos genes y cuyo esquema se muestra en la figura 1 , en tanto que las secuencias de los cebadores se presentan en el cuadro 1. Como control para la normalización se amplificó la región E7 con los cebadores descritos en la sección de expresión de E7 para HPV-16.

En la primera reacción se amplificaron los fragmentos 1 y 3, y en la segunda, los fragmentos 2 y 4 (figura 1 ) para evitar inespecificidad en la reacción. Los productos se corrieron en electroforesis en un gel de agarosa al 1,5 % de acuerdo con la metodología descrita por Lukaszuk, et al ., en el 2003 (25). Posteriormente, se hallaron las densitometrías para cada fragmento de los amplicones E1, E2 y E7, utilizando un documentador de geles GelDoc ® BioRad y el programa ImageLab ™ .
Mediante la cuantificación de la relación E1-E2/E7, se detectaron los estados físicos (episómico, integrado o mixto), los cuales se habían normalizado previamente con las razones densitométricas de E1-E2/E7 del plásmido HPV-16, que se utiliza como referencia para la forma episómica pura y ayuda a normalizar variaciones en la cinética de la PCR según la metodología desarrollada por Shukla, et al ., en el 2014 (26). Además, se empleó ADN de células CaSki (500 copias) y SiHa (una copia) como referencia de integración del genoma del HPV-16.
La normalización de E1-E2/E7 de las muestras clínicas con respecto al plásmido, se calculó de la siguiente manera:

Un valor igual a 0 en la normalización de las muestras clínicas, es decir, ausencia total en la amplificación de los genes E1 y E2 , correspondía a la forma integrada pura del genoma del HPV-16, un valor de 1 o superior correspondía a la forma episómica pura, y los valores mayores de 0 y menores de 1 correspondían a la forma mixta (integrada y episómica) del ADN del HPV-16 (26).
La PCR se hizo con GoTaq Flexi Promega ® usando 1X de solución tampón, 1,5 mM de MgCl 2, 100 mM de dNTP, 10 nM de cada cebador y 1 U
de polimerasa Taq , para un volumen final de 25 µl. Los ciclos fueron los siguientes: uno a 94 °C durante 5 minutos, seguido de 35 ciclos a 94 °C durante un minuto, a 62 °C durante otro minuto, a 72 °C durante 1,5 minutos, y un ciclo final a 72 °C durante 10 minutos.
Análisis estadístico
El análisis estadístico fue descriptivo y se utilizaron frecuencias relativas y absolutas, así como medidas de tendencia central. La comparación entre los grupos positivos y negativos para el HPV con respecto a las variables categóricas, se analizaron mediante la prueba no paramétrica de Pearson (ji al cuadrado) en el programa SPSS ® . La significación estadística se estableció con un valor de p=0,05.
Resultados
En el estudio se incluyeron 46 pacientes con diagnóstico de carcinoma de células escamosas en la cavidad oral confirmado histopatológicamente. Después de la firma del consentimiento informado, se les solicitó a todos los pacientes responder a una encuesta sociodemográfica para recabar información sobre algunos factores de riesgo asociados a este tipo de tumor.
Características sociodemográficas
En el cuadro 2 se resumen las características sociodemográficas de la población objeto del estudio según la presencia o ausencia del HPV. Se observó que 67,39 % de los pacientes eran de sexo masculino, y 78,25 % eran mayores de 50 años; 54,35 % de ellos afirmó haber tenido entre una y dos parejas sexuales. En cuanto a los factores de riesgo, se encontró que 80,43 % (37/46) de los pacientes no fumaba, 67,39 % (31/46) no consumía alcohol y 6,5 % (3/46) consumía tabaco y alcohol. Con respecto al estrato socioeconómico, se encontró que 54,35 % de los pacientes pertenecía al estrato medio. En cuanto al lugar de procedencia, la mayoría de los pacientes provenía de Manizales, (45,65 %; 21/46) y de Bogotá (43,48 %; 20/46).

Tipos de HPV
En diez de los pacientes se detectó la presencia de HPV de alto riesgo, es decir, una frecuencia de 21,74 %. La prueba de ji al cuadrado mostró diferencias estadísticamente significativas en las regiones geográficas donde se recolectaron las muestras (p=0,037), evidenciándose en Manizales una asociación significativa con respecto a la infección por HPV de alto riesgo, en comparación con Bogotá y Bucaramanga.
En cuanto al genotipo más frecuente, se encontró que en nueve de las diez (90 %) muestras positivas este correspondía al HPV-16. El otro tipo viral de alto riesgo fue el HPV-58, el cual se encontró en el restante 10 %.
Niveles de expresión del HPV-16
Con base en los resultados de la genotipificación del HPV realizada con la técnica de Luminex ® , los niveles de expresión del genotipo HPV-16 (el tipo viral más prevalente en la población de estudio), se determinaron mediante cuantificación absoluta con una PCR en tiempo real. Con este fin se construyó una curva estándar con plásmido a partir de un millón de copias hasta llegar a una, con lo cual se obtuvo un coeficiente de determinación (R 2 ) de 0,99.
La determinación de los niveles de expresión fue posible en seis de las nueve muestras (66,7 %), en la cual el número de copias transcritas en 500 ng de ADNc osciló entre una y 11 copias. Las copias por debajo de 1 se consideraron como inactivas en la transcripción (cuadro 3).

Estado físico del HPV-16
Se determinó el estado físico del HPV-16 mediante PCR múltiple con dos reacciones para amplificar la región completa de los genes E1 y E2 . En la primera reacción se amplificaron los fragmentos 1 y 3, y en la segunda, los fragmentos 2 y 4; también se amplificó la región E7 como control en las dos reacciones. En el cuadro 4 se muestran las razones densitométricas halladas para cada fragmento.
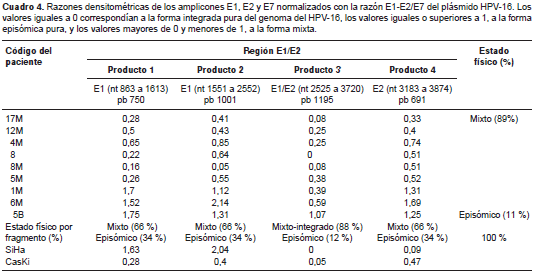
De acuerdo con los resultados obtenidos de las razones densitométricas en las muestras normalizadas, se determinó que ocho de nueve muestras (89 %) presentaban un estado físico mixto (episómico e integrado) para el HPV-16 y una de nueve muestras (11 %) presentó un estado físico episómico, con prevalencia de la disrupción en el sitio de unión de E1 y E2 correspondiente al producto 3.
Con base en estos resultados, se compararon los niveles de expresión y el estado físico del HPV-16, y se determinó que no había diferencia significativa en el incremento de la expresión del gen E7 en las formas mixtas o episómicas del genoma.
Discusión
El HPV puede ser un factor de riesgo para el carcinoma de células escamosas en la cavidad oral. En el presente estudio se encontró una tasa de prevalencia baja de HPV (21,74 %) comparada con lo informado en otros países del mundo: Estados Unidos (72 %) (27), Canadá (53 %) (9), Alemania (30 a 50 %) y los países escandinavos (90%) (19). Sin embargo, este porcentaje fue más alto que el reportado en un estudio de cabeza y cuello realizado en Medellín por Quintero, et al. , en el cual la tasa de prevalencia de HPV en la cavidad oral fue de 13,3 % determinada con la técnica de reverse line blot (13). Una posible explicación de las diferencias de prevalencia sería el tipo de técnica utilizada; en la técnica de reverse line blot se utilizan los cebadores GP5+/GP6+, los cuales amplifican la región L1, en tanto que en la técnica de Luminex (utilizada en este estudio), además de estos cebadores, se emplean ocho cebadores sentido y dos antisentido de amplio espectro, que amplifican la misma región y se denominan BSGP5+/BIO-BSGP6+, lo cual permite una mayor detección de ADN viral.
En este estudio, los casos positivos para HPV fueron ligeramente más frecuentes en hombres (25,81 %) que en mujeres (13,33 %), información que coincide con lo reportado en otros informes sobre una mayor incidencia de las infecciones orales por HPV en hombres que en mujeres (7). Con respecto a la edad, aunque no se encontraron diferencias estadísticamente significativas y la mayoría de los pacientes era mayor de 50 años, se encontró una tendencia a registrar una mayor prevalencia de la infección con HPV en las personas entre los 31 y los 40 años de edad, lo cual también corrobora otros estudios en los que, generalmente, los casos positivos para HPV se presentan más entre las personas más jóvenes (6,10,28).
En el presente estudio no se encontró una diferencia estadísticamente significativa entre la infección oral por HPV y el número de parejas sexuales; sin embargo, los casos positivos para HPV tendieron a presentarse más en pacientes con más de dos parejas sexuales. Otros estudios han demostrado que un gran número de parejas y la práctica de sexo oral aumentan las probabilidades de adquirir la infección por el HPV (29).
En cuanto a otros factores de riesgo, los resultados obtenidos en este estudio para los casos positivos para HPV se registraron tanto en las personas que no consumían alcohol ni tabaco, como en las que lo hacían, y fueron muy similares a los encontrados en otras partes del mundo (28,29). En otros estudios se han encontrado asociaciones estadísticamente significativas al establecer que el consumo de más de diez paquetes de cigarrillo al año en pacientes positivos para HPV aumentaba el riesgo de muerte (30).
Con respecto a las regiones geográficas de recolección de las biopsias, se encontró una diferencia estadísticamente significativa en la frecuencia de infección por HPV de alto riesgo entre las muestras de pacientes procedentes de Manizales (p=0,037) y aquellas de otras ciudades. Una posible explicación puede estar relacionada con el incremento del número de parejas sexuales, pues aunque no se encontraron diferencias estadísticamente significativas, sí se registró una tendencia a presentar más de dos parejas sexuales en las personas provenientes de dicha ciudad.
El tipo viral detectado con mayor frecuencia en la población de estudio fue el HPV-16 (90 %), seguido por el HPV-58 (10 %). Esta frecuencia es más alta que la reportada por Steinau, et al ., en el 2014, en cuyo estudio la frecuencia del genotipo HPV-16 fue de 60,5 % en Estados Unidos (27), aunque es necesario aclarar que la población de estudio fue mucho mayor (403 casos). La alta frecuencia de HPV-16 ratifica lo encontrado en la mayoría de las publicaciones, e indica que este tipo viral es el más persistente en los casos de carcinoma de células escamosas en la cavidad oral en el mundo y es considerado como un factor de riesgo para su desarrollo (9,31,32). Los estudios sobre la presencia del HPV-58 en este cáncer son escasos, ya que este tipo viral es poco frecuente en esta enfermedad. En un estudio de Baradacco, et al., llevado a cabo en el 2007 en Italia, se reportó una frecuencia de 4,7 % para este tipo viral en 115 pacientes con carcinoma de células escamosas de cabeza y cuello, de los cuales 21 fueron positivos para HPV (32). En un estudio de 2013, Baboci, et al. , reportaron actividad biológica del virus HPV-58 en tejido tumoral de personas con carcinoma de células escamosas en la cavidad oral, lo cual demostró su implicación en el desarrollo del carcinoma (33).
Se ha establecido que el potencial oncogénico del HPV-16 reside en la expresión de las oncoproteínas virales E6 y E7, las cuales interrumpen la vía de señalización de p53 y pRb; por lo tanto, para analizar la actividad oncogénica del HPV es necesario determinar si el virus se transcribe o no (6). En algunos estudios se ha enfatizado en la importancia de determinar la presencia del virus, ya que los pacientes positivos para la infección viral muestran un mejor pronóstico que los negativos. Por otro lado, la supervivencia de los pacientes positivos para HPV-16 en quienes, además, el virus está activo en la transcripción, es mayor comparada con los pacientes positivos para HPV-16 inactivo en la transcripción (34).
En resumen, la presencia viral y la expresión de E6 y E7 son un indicativo del pronóstico del paciente. En su metanálisis del 2014, Ndiaye, et al. , reportaron como biomarcadores del cáncer de cabeza y cuello la presencia de ADN del HPV, de transcritos virales y de la oncoproteína p16INK4a (12). Por el contrario, en el 2012 Holzinger, et al., observaron que la oncoproteína p16INK4a no mostraba ningún valor pronóstico, pero que los pacientes con ausencia de los patrones de ARN E6*I o E6*II (descritos con anterioridad en el modelo de cáncer de cuello uterino) presentaban un comportamiento similar a los pacientes negativos para la infección por HPV, lo cual sugeriría que los mejores biomarcadores, además de la presencia del ADN viral, son los patrones de ARN (35).
En el presente estudio se evaluó el número de copias transcritas de HPV-16 utilizando ARNm de la región E7 mediante PCR cuantitativa en tiempo real, y se encontró que el número de copias activas en la transcripción osciló entre uno y 11. Es decir, los niveles de expresión analizados en las muestras fue bajo y solo se evidenciaron en seis de las nueve muestras positivas para HPV-16 (66 %). Similares resultados se encontraron en un estudio de carcinoma de células escamosas en la cavidad oral realizado en Francia, en el cual se reportó que, de 24 casos positivos para HPV, 16,50 % de las muestras expresaba las oncoproteínas E6 y E7 (34). Igualmente, los resultados de otro estudio difieren de lo reportado en el nuestro, ya que ninguna de las 91 muestras positivas para HPV-16 se encontraba activa en la transcripción (36). Es importante señalar que hubiera sido interesante medir el número de copias con ADN viral para determinar cuántas de ellas se encontraban activas en la transcripción. Holzinger, et al. , demostraron que las muestras de los pacientes con carcinoma de células escamosas en la cavidad oral con carga viral baja de HPV-16 se encontraban activas en la transcripción (35).
En cuanto al estado físico de los HPV de alto riesgo, algunos autores han establecido que el virus puede integrarse al genoma del huésped por ruptura de los genes virales E1 y E2 , que son los encargados de controlar negativamente la expresión de E6 y E7 , con lo cual el virus puede persistir e incrementar el riesgo de desarrollar cáncer (37). En la línea de células de cuello uterino W12, se demostró la integración del HPV-16, el cual provoca un aumento de la expresión de los oncogenes E6 y E7 , en comparación con los que se encuentran en estado episómico (38). En contraste, en un estudio en queratinocitos primarios inmortalizados, con presencia de genomas de HPV-16, se demostró que la interrupción de la secuencia del gen E2 tras la integración viral no aumentaba la expresión de los oncogenes virales E6 y E7 (39). Por ello, en el presente estudio se analizó el estado físico del HPV-16 en el carcinoma de células escamosas en la cavidad oral.
El estado físico del HPV-16 en las muestras se analizó mediante PCR múltiple, y se encontró que el estado físico viral más frecuente fue la forma mixta (89 %), seguida de la forma episómica (11 %). La disrupción del genoma viral para integrarse al genoma de la célula huésped, ocurrió en diferentes regiones de los genes E1 y E2 , prevaleciendo la disrupción en el sitio de unión de E1 y E2 (2.525 a 3.720 nucleótidos). Estos resultados difieren con lo reportado por algunos autores. Por ejemplo, en 2014, Olthof, et al. , mediante PCR mediada por ligadura, encontraron que en 75 pacientes con carcinoma de células escamosas en la cavidad oral positivos para HPV-16 el estado físico más frecuente fue el episómico (61 %) y el menos frecuente, el integrado (39 %). Encontraron, además, que la integración del ADN viral afectaba con mayor frecuencia los sitios de unión de los genes E1 y E2 (62 %), seguidos por el rompimiento del gen E2 (38 %) (39), lo cual coincide parcialmente con lo encontrado en el presente estudio. En otros estudios en los que se analizaban diferentes regiones anatómicas de cabeza y cuello, se ha reportado que en las amígdalas el genotipo viral más frecuente es el HPV-16 (cinco de seis casos), seguido del HPV-35 (uno de seis casos); además, utilizando PCR múltiple para amplificar las regiones E1, E2 y E6, se encontró que el estado físico más prevalente era el integrado (32). Estos hallazgos contradicen los reportados por Mellin, et al , en 2002, quienes encontraron por medio del método rliPCR ( Restriction enzyme cleavage, Ligation and PCR ) (40) que el estado físico del HPV-16 más frecuente en las amígdalas era el episómico (ocho de 11 casos), seguido del mixto (dos de 11 casos) y del integrado (uno de 11 casos). Con base en lo expuesto se puede inferir que no hay un tipo de técnica estandarizada para determinar el estado físico del genoma viral, lo cual puede repercutir en la heterogeneidad de los resultados de los diferentes estudios.
Los resultados del presente estudio no evidenciaron diferencias en la expresión del gen E7 cuando el genoma viral de HPV-16 estaba en forma episómica o mixta. Estos resultados son similares a los reportados por Olthof, et al. , en su estudio del 2014, en el cual demostraron que la integración del genoma del HPV-16 no aumentaba los niveles de expresión de las oncoproteínas E6 y E7 en el carcinoma de células escamosas en la cavidad oral; asimismo, se encontró que los niveles de expresión del gen E2 no se veían afectados en el estado fisico episómico o integrado (39).
Entre las limitaciones del estudio debe mencionarse que la muestra se seleccionó por conveniencia, con un total de 46 casos en el momento de la cirugía, y que no fue posible conocer el estadio del cáncer en todos los casos, por lo cual este criterio no se tuvo en cuenta.
A los pacientes del Hospital Universitario San Ignacio, del Hospital de Manizales y del Hospital de Bucaramanga participantes en el estudio.
Los autores declaran no tener conflicto de intereses.
Este estudio fue financiado por la Pontificia Universidad Javeriana en el marco del proyecto "Genotipificación, niveles de expresión y estado de integración del virus de papiloma humano en el carcinoma orofaríngeo de células escamosas" (PUJ ID de proyecto 5283).
Correspondencia:
Dabeiba Adriana García, Facultad de Odontología, Pontificia Universidad Javeriana, Carrera 7 N° 40-62, Bogotá, D.C., Colombia
Teléfono: (571) 320 8320, extensión 2899 garciad@javeriana.edu.co
1. BarnesL, Eveson JW, Reichart P, Sidransky D. World Health Organization Classification of tumours. Pathology and Genetics of Head and Neck Tumours . Lyon: IARC Press; 2005. p. 168-75.
2. Westra WH. The morphologic profile of HPV-related head and neck squamous carcinoma: Implications for diagnosis, prognosis, and clinical management. Head Neck Pathol. 2012;6:48-54. http://dx.doi.org/10.1007/s12105-012-0371-6
3. Woods R, O´Regan EM, Kennedy S, Martin C, O´Leary JJ, Timon C. Role of human papillomavirus in oropharyngeal squamous cell carcinoma: A review. World J Clin Cases. 2014;2:172-93. http://dx.doi.org/10.12998/wjcc.v2.i6.172
4. Chaturvedi AK, Engels EA, Anderson WF, Gillison ML. Incidence trends for human papillomavirus-related and -unrelated oral squamous cell carcinomas in the United States. J Clin Oncol. 2008;26:612-9. http://dx.doi.org/10.1200/JCO.2007.14.1713
5. International Agency for Research on Cancer. GLOBOCAN 2012. Estimated cancer incidence, mortality and prevalence worldwide in 2012. Fecha de consulta: 20 de febrero de 2015. Disponible en: http://globocan.iarc.fr/Pages/fact_sheets_population.aspx.
6. van Monsjou HS, Balm AJ, Brekel MM, Wreesmann VB. Oropharyngeal squamous cell carcinoma: A unique disease on the rise?. Oral Oncol. 2010;46:780-5. http://dx.doi.org/10.1016/j.oraloncology.2010.08.011
7. Genden EM, Sambur IM, de Almeida JR, Posner M, Rinaldo A, Rodrigo JP, et al . Human papillomavirus and oropharyngeal squamous cell carcinoma: What the clinician should know. Eur Arch Otorhinolaryngol. 2013;270:405-16. http://dx.doi.org/10.1007/s00405-012-2086-4
8. Hafkamp HC, Manni JJ, Speel EJ. Role of human papillomavirus in the development of head and neck squamous cell carcinomas. Acta Otolaryngol. 2004;124: 520-6.
9. Nichols AC, Dhaliwal SS, Palma DA, Basmaji J, Chapeskie C, Dowthwaite S, et al . Does HPV type affect outcome in oropharyngeal cancer? J Otolaryngol Head Neck Surg. 2013;42:1-9. http://dx.doi.org/10.1186/1916-0216-42-9
10. Evans M, Newcombe R, Fiander A, Powell J, Rolles M, Thavaraj S, et al. Human papillomavirus-associated oropharyngeal cancer: An observational study of diagnosis, prevalence and prognosis in a UK population. BMC Cancer. 2013;13:1-10. http://dx.doi.org/10.1186/1471-2407-13-220
11. Machiels JP, Lambrecht M, Hanin FX, Duprez T, Gregoire V, Schmitz S, et al. Advances in the management of squamous cell carcinoma of the head and neck. F1000prime Rep. 2014;6:44. http://dx.doi.org/10.12703/P6-44
12. Ndiaye C, Mena M, Alemany L, Arbyn M, Castellsagué X, Laporte L, et al . HPV DNA, E6/E7 mRNA, and p16INK4a detection in head and neck cancers: A systematic review and meta-analysis. Lancet Oncol. 2014;15:1319-31. http://dx.doi.org/10.1016/S1470-2045(14)70471-1
13. Quintero K, Giraldo GA, Uribe ML, Baena A, López C, Alvarez E, et al . Human papillomavirus types in cases of squamous cell carcinoma of head and neck in Colombia. Braz J Otorhinolaryngol. 2013;79:375-81. http://dx.doi.org/10.5935/1808-8694.20130065
14. Schmitt M, Dondog B, Waterboer T, Pawlita M. Homogeneous amplification of genital human alpha papillomaviruses by PCR using novel broad-spectrum GP5+ and GP6+ primers. J Clin Microbiol. 2008;46:1050-9. http://dx.doi.org/10.1128/JCM.02227-07
15. Muñoz N, Bosch FX, de San José S, Herrero R, Castellsagué X, Shah KV, et al . Epidemiologic classification of human papillomavirus types associated with cervical cancer. N Engl J Med. 2003;348:518-27. http://dx.doi.org/10.1056/NEJMoa021641
16. de Villiers EM, Fauquet C, Broker TR, Bernard HU, zur Hausen H. Classification of papillomaviruses. Virology. 2004;324:17-27. http://dx.doi.org/10.1016/j.virol.2004.03.033
17. Marklund L, Hammarstedt L. Impact of HPV in Oropharyngeal Cancer. J Oncol. 2011;2011:1-6. http://dx.doi.org/10.1155/2011/509036
18. Betiol J, Villa LL, Sichero L. Impact of HPV infection on the development of head and neck cancer. Braz J Med Biol Res. 2013;46:217-26. http://dx.doi.org/10.1590/1414-431X20132703
19. Wittekindt C, Wagner S, Mayer CS, Klussmann JP. Basics of tumor development and importance of human papilloma virus (HPV) for head and neck cancer. GMS Curr TopOtorhinolaryngol Head Neck Surg. 2012;11:1-29. http://dx.doi.org/10.3205/cto000091
20. Castillo A. HPV infection and carcinogenesis in the upper aero-digestive tract. Colomb Med. 2011;42:233-42.
21. Feller L, Wood NH, Khammissa NA, Lemmer J. Human papillomavirus mediated carcinogenesis and HPV-associated oral and oropharyngeal squamous cell carcinoma. Part 1: Human papillomavirus-mediated carcinogenesis. Head Face Med. 2010;6:1-5. http://dx.doi.org/10.1186/1746-160X-6-15.
22. Narisawa-Saito M, Kiyono T. Basic mechanisms of high-risk human papillomavirus-induced carcinogenesis: Roles of E6 and E7 proteins. Cancer Sci. 2007;98:1505-11. http://dx.doi.org/10.1111/j.1349-7006.2007.00546.x
23. Bisht M, Bist SS. Human papilloma virus: A new risk factor in a subset of head and neck cancers. J Cancer Res Ther. 2011;7:251-5. http://dx.doi.org/10.4103/0973-1482.87004
24. Montalvo M, Resendiz M, Santos G, Vallejo V, Reyes J, Hernández J. Estandarización de un método de detección molecular del virus influenza (H5N1) de alta patogenicidad. Acta Bioquím Clín Latinoam. 2009;43:49-52.
25. Lukaszuk K, Liss J, Wozniak I, Emerich J, Wójcikowski C. Human papillomavirus type 16 status in cervical carcinoma cell DNA assayed by multiplex PCR. J Clin Microbiol. 2003;41:608-12. http://dx.doi.org/10.1128/JCM.41.2.608-612.2003
26. Shukla S, Mahata S, Shishodia G, Pande S, Verma G, Hedau S, et al. Physical state & copy number of high risk human papillomavirus type 16 DNA in progression of cervical cancer. Indian J Med Res. 2014;139:531-43.
27. Steinau M, Saraiya M, Goodman MT, Peters ES, Watson M, Cleveland JL, et al. Human papillomavirus prevalence in oropharyngeal cancer before vaccine introduction, United States. Emerg Infect Dis. 2014;20:822-8. http://dx.doi.org/10.3201/eid2005.131311
28. Marur S, D´Souza G, Westra WH, Forastiere AA. HPV-associated head and neck cancer: A virus-related cancer epidemic. Lancet Oncol. 2010;11:781-9. http://dx.doi.org/10.1016/S1470-2045(10)70017-6
29. D´Souza G, Kreimer A, Viscidi R, Pawlita M, Fakhry C, Koch WM, et al . Case-control study of human papillomavirus and oropharyngeal cancer. N Eng J Med. 2007;356:1944-56. http://dx.doi.org/10.1056/NEJMoa065497
30. Ang KK, Harris J, Wheeler R, Weber R, Rosenthal DI, Nguyen-Tân PF, et al. Human papillomavirus and survival of patients with oropharyngeal cancer. N Eng J Med. 2010;363:24-35. http://dx.doi.org/10.1056/NEJMoa0912217
31. Kreimer AR, Clifford GM, Boyle P, Franceschi S. Human papillomavirus types in head and neck squamous cell carcinomas worldwide: A systematic review. Cancer Epidemiol Biomarkers Prev. 2005;14:467-75. http://dx.doi.org/10.1158/1055-9965.EPI-04-0551
32. Badaracco G, Rizzo C, Mafera B, Pichi B, Giannarelli D, Rahimi SS, et al . Molecular analyses and prognostic relevance of HPV in head and neck tumours. Oncol Rep. 2007;17:931-9. http://dx.doi.org/10.3892/or.17.4.931
33. Baboci L, Boscolo-Rizzo P, Holzinger D, Bertorelle R, Biasini L, Michel A, et al . Evidence of the causal role of human papillomavirus type 58 in an oropharyngeal carcinoma. Virol J. 2013;10:1-6. http://dx.doi.org/10.1186/1743-422X-10-334
34. Jung AC, Briolat J, Millon R, de Reyniès A, Rickman D, Thomas E, et al . Biological and clinical relevance of trasncriptionally active human papillomavirus (HPV) infection in oropharynx squamous cell carcinoma. Int J Cancer. 2010;126:1882-94. http://dx.doi.org/10.1002/ijc.24911
35. Holzinger D, Schmitt M, Dyckhoff G, Benner A, Pawlita M, Bosch FX. Viral RNA patterns and high viral load reliably define oropharynx carcinomas with active HPV16 involvement. Cancer Res. 2012;72:4993-5003. http://dx.doi.org/10.1158/0008-5472.CAN-11-3934
36. Rietbergen M, Braakhuis B, Moukhtari N, Bloemena E, Brink A, Sie D, et al . No evidence for active human papillomavirus (HPV) in fields surrounding HPV-positive oropharyngeal tumors. J Oral Pathol Med. 2014;43:137-42. http://dx.doi.org/10.1111/jop.12123
37. Lewis JS, Ukpo OC, Ma XJ, Flanagan JJ, Luo Y, Thorstad WL, et al . Transcriptionally-active high-risk human papillomavirus is rare in oral cavity and laryngeal/hypopharyngeal squamous cell carcinomas –a tissue microarray study utilizing E6/E7 mRNA in situ hybridization. Histopathology. 2012;60:982-91. http://dx.doi.org/10.1111/j.1365-2559.2011.04169.x
38. Jeon SY, Lambert PF. Integration of human papillomavirus type 16 DNA into the human genome leads to increased stability of E6 and E7 mRNAs: Implications for cervical carcinogenesis. Proc Natl Acad Sci USA. 1995;92:1654-8.
39. Olthof NC, Speel EM, Kolligs J, Haesevoets A, Henfling M, Ramaekers FC, et al . Comprehensive analysis of HPV16 integration in OSCC reveals no significant impact of physical status on viral oncogene and virally disrupted human gene expression. PloS One. 2014;9:1-8. http://dx.doi.org/10.1371/journal.pone.0088718
40. Mellin H, Dalhgren L, Munck-Wikland E, Lindholm J, Rabbani H, Kalantari M, et al . Human papillomavirus type 16 is episomal and a high viral load may be correlated to better prognosis in tonsillar cancer. Int J Cancer. 2002; 102:152-8. http://dx.doi.org/10.1002/ijc.10669