Biomédica 2016;36:504-8
doi: http://dx.doi.org/10.7705/biomedica.v36i4.2968
PRESENTACIÓN DE CASO
1 Servicio de Medicina Interna, Fundación Cardioinfantil-Instituto de Cardiología, Bogotá, D.C., Colombia
2 Servicio de Neumología, Fundación Neumológica de Colombia, Bogotá, D.C., Colombia
Contribución de los autores:
Leslie Vargas: seguimiento clínico del paciente Madeleine Barrera: recolección de los datos, digitalización de imágenes y resumen del caso
Ambas autoras hicieron la revisión de la literatura científica y el análisis.Recibido: 13/07/15; aceptado: 13/05/16
La osificación pulmonar es un hallazgo poco usual, generalmente asintomático, que se reporta como incidental en biopsias de pulmón. Asimismo, la hemosiderosis pulmonar idiopática es una causa poco frecuente de infiltración pulmonar. Se presenta el caso de un hombre de 64 años con síntomas respiratorios crónicos, en quien se detectaron estas dos condiciones en el estudio histopatológico.
Palabras clave: osteogénesis; hemosiderosis; pulmón; informes de casos.
doi: http://dx.doi.org/10.7705/biomedica.v36i4.2968
Idiopathic pulmonary hemosiderosis with dendriform pulmonary ossification
Pulmonary ossification is a rare and usually asymptomatic finding reported as incidental in lung biopsies. Similarly, idiopathic pulmonary hemosiderosis is a rare cause of pulmonary infiltrates. We report the case of a 64-year old man with chronic respiratory symptoms in whom these two histopathological findings converged.
Key words: Osteogenesis; hemosiderosis; lung; case reports.
doi: http://dx.doi.org/10.7705/biomedica.v36i4.2968
La hemosiderosis pulmonar idiopática del adulto y la osificación pulmonar son poco frecuentes, y su etiología no es clara. Habitualmente, son hallazgos incidentales en biopsias pulmonares.
Se presenta el caso de un hombre de 64 años, sintomático respiratorio crónico y sin antecedentes patológicos, ni de tabaquismo o exposición a otras sustancias tóxicas, en cuyo estudio histopatológico se evidenció la presencia de estas dos condiciones. En la consulta, el paciente relató haber padecido de tos seca durante 30 años, predominantemente en las mañanas, en ocasiones con vómito, y acompañada de disnea de instauración insidiosa.
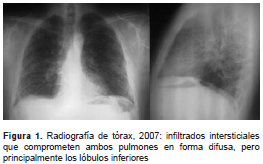
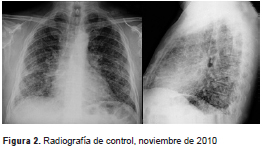
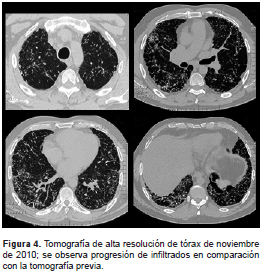
En el examen físico se encontró baja saturación de oxígeno y estertores finos de predominio inspiratorio en ambos campos pulmonares. En la radiografía de tórax se evidenciaron opacidades intersticiales de tipo reticulonodulares difusas bilaterales (figura 1 y figura 2) y, posteriormente, en la tomografía de alta resolución de tórax se detectaron opacidades intersticiales con engrosamiento de los tabiques interlobulillares, principalmente en la base pulmonar, y múltiples micronódulos (figura 3 y figura 4).


Se le practicó una biopsia pulmonar por toracos-copia, en la cual se reportó pérdida de arquitectura del pulmón, fibroantracosis perivascular, hemorragia alveolar reciente y antigua con alvéolos llenos de hematíes y macrófagos pardos, hemosiderófagos con la coloración para hierro y presencia de espículas con medula ósea en la luz de los alvéolos. Con base en todos estos exámenes, se diagnosticó hemosiderosis y osificación pulmonar.
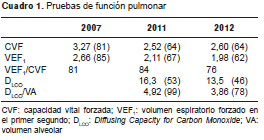
Las pruebas de la función pulmonar demostraron una alteración restrictiva que siguió avanzando en los años de seguimiento, así como disminución de la capacidad de difusión del monóxido de carbono (cuadro 1).
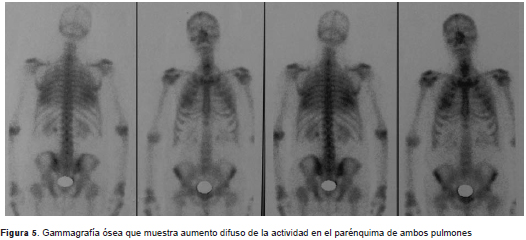
En el ecocardiograma transtorácico, se descartaron enfermedad valvular y falla cardiaca. En la gammagrafía ósea se observó captación del trazador en ambos campos pulmonares.
Los valores elevados de hierro sérico y ferritina (cuadro 2) llevaron a sospechar la presencia de hemocromatosis, probablemente genética, aunque no se documentaron niveles tan elevados de hierro como los que caracterizan la enfermedad ni tampoco se evidenció compromiso hepático o miocárdico. Se planteó la posibilidad de una hemocromatosis genética resultante en hemosiderosis pulmonar, cuya cronicidad y falta de tratamiento provocaron la aparición de la osificación pulmonar (figura 5).

A continuación se presenta una revisión de las enfermedades que confluyeron en este paciente.
Obtención de los datos
Se hizo una revisión sistemática de la literatura científica en PubMed, Medline, Lilacs y Gloogle Académico, sin limitaciones de idioma, tipo de artículo o fecha de publicación, excepto para el caso de la hemosiderosis pulmonar, que se limitó a mayores de 19 años. Se utilizaron las siguientes palabras clave y términos MESH: osteogenesis or ossification, lung and idiopathic pulmonary hemosiderosis. Se encontraron 151 artículos, de los cuales solo el 24 % correspondía a osificación pulmonar idiopática, y que, en general, eran reportes de caso. Finalmente, se tuvieron en cuenta 26 artículos con información útil sobre la etiología, el diagnóstico y el tratamiento de las dos enfermedades. No se encontró ningún reporte de caso en el cual se presentaran ambas en un solo paciente.
Consideraciones éticas
La publicación del caso se hace con la autorización del paciente.
Revisión
La hemosiderosis pulmonar idiopática fue descrita por primera vez como “endurecimiento de pulmón marrón” por Rudolf Virchow en 1864, en la autopsia de algunos pacientes; posteriormente, Wilhelm Ceelen (1) correlacionó estos resultados con los síntomas clínicos de dos niños que murieron de hemosiderosis pulmonar idiopática en 1931, por lo que también se la conoce como síndrome de Ceelen (2). En cuanto a la osificación pulmonar, fue descrita por primera vez por Hubert von Luschka en 1856 (3).
La hemosiderosis pulmonar idiopática es una rara enfermedad que se presenta principalmente en niños; causa recurrentes episodios de hemorragia alveolar difusa que, eventualmente, pueden desembocar en fibrosis pulmonar (4).La hemosiderina es el pigmento de color amarillo dorado o pardo y aspecto granuloso o cristalino, proveniente de la conversión del hierro de la hemoglobina por los macrófagos alveolares. Se denomina hemosiderosis a la acumulación de hemosiderina en los tejidos, observable mediante la tinción en fresco con azul de Prusia. Entre las causas de la condición se ha propuesto su origen inmunitario, ya que se han detectado complejos inmunitarios circulantes en suero en algunos pacientes, y se ha observado que en el 25 % de aquellos con diagnóstico de hemosiderosis pulmonar idiopática se presenta alguna enfermedad autoinmunitaria a los 10 años del diagnóstico inicial (1).
Otra teoría propone una probable relación con un componente alérgico en los casos asociados con la enfermedad celiaca y la mejoría de las alteraciones radiológicas al suprimir el gluten de la dieta (5), relación que se conoce con el nombre de síndrome de Lane-Hamilton. La hipótesis que postula un origen inflamatorio se basa en factores ambientales, como el hongo Stachybotrys chartarum (moho), los cuales favorecen la acumulación de neutrófilos en la membrana alvéolo-capilar y causan su disrupción. Por último, la teoría del origen metabólico plantea la presencia de un defecto de la enzima hemooxigenasa 1, encargada de catalizar la eliminación del hierro de la hemoglobina, la cual puede ser inducida por factores de estrés celular y limitar la capacidad de los macrófagos alveolares de metabolizar la hemoglobina.
La enfermedad presenta diversas manifestaciones, que van desde un cuadro clínico caracterizado por el inicio agudo de hemoptisis y disnea, hasta uno de evolución insidiosa de disnea progresiva, fatiga y anemia. Casi todos los pacientes adultos desarrollan hemoptisis de diversa gravedad (6). En cerca del 20 % de los pacientes hay hepatomegalia o esplenomegalia (7).
Tras un episodio agudo con hemorragia pulmonar, las radiografías de tórax muestran opacidades alveolares que pueden remitir durante la fase asintomática. En la tomografía de alta resolución de tórax, se pueden observar opacidades mal definidas, unilaterales o bilaterales, con un patrón de ocupación alveolar de predominio basal en los campos pulmonares. Las opacidades varían en intensidad según la magnitud de la hemorragia alveolar y el tiempo transcurrido desde el último episodio de sangrado. Los pacientes cuya enfermedad ha sido de larga evolución ocasionalmente pueden desarrollar múltiples quistes focales, de predominio posterior y en los segmentos basales laterales (8).
La sospecha clínica de hemorragia requiere la confirmación mediante lavado broncoalveolar (9,10), el cual se hace generalmente en segmentos del pulmón donde la tomografía haya evidenciado opacidad del tipo de vidrio esmerilado, o en el lóbulo medio si la enfermedad es difusa. En adultos se requiere la biopsia pulmonar para confirmar el diagnóstico de hemosiderosis pulmonar idiopática (11).
El tratamiento se enfoca en las causas detectadas. La administración de corticoides debe iniciarse con una dosis de 1 a 2 mg/kg diarios por vía intravenosa en los casos graves, la cual deberá disminuirse a la dosis de mantenimiento de 0,5 a 0,75 mg/kg diarios durante18 a 24 meses (12,13).
El tratamiento inmunosupresor puede emplearse conjuntamente con glucocorticoides orales en los pacientes con enfermedad grave o con episodios recurrentes de hemorragia alveolar. Se han utilizado con éxito la azatioprina, la hidroxicloroquina, la ciclofosfamida y la 6-mercaptopurina en combinación con glucocorticoides orales; sin embargo, la información que sustenta la eficacia de este enfoque es limitada (14,15).
En cuanto a la osificación pulmonar, esta se define como la presencia histológica de hueso maduro, con contenido de médula ósea o sin él, en el intersticio o en los espacios alveolares (3), y se asocia con antecedentes de enfermedad pulmonar, cardíaca o en otros órganos, confirmada por histopatología. Generalmente, su diagnóstico es incidental (16). La relación de hombre a mujer en mayores de 80 años es de 7 a 1 y, en menores de 80 años, de 1 a 1 (3).
Según el patrón histopatológico, se han descrito dos formas de presentación: granular y dendriforme (17). La forma granular, también conocida como nodular circunscrita, es la más común y se caracteriza por depósitos laminares de material óseo calcificado dentro de los espacios alveolares, frecuentemente sin elementos medulares. La forma dendriforme, o ramificada, se relaciona con la bifurcación intersticial de espículas óseas que contienen elementos medulares con actividad osteoblástica y osteoclástica y que pueden protruir dentro de los alvéolos.
En diversos artículos se menciona que, en los casos asociados con congestión venosa pulmonar crónica, la hemorragia alveolar es un factor predisponente para la aparición de fibrosis y osificación (18).
El diagnóstico es incidental en casos aislados estudiados post mortem (19), o se hace con base en los hallazgos de estudios histopatológicos posteriores a cirugías (17). Su curso clínico generalmente es asintomático, o con síntomas relacionados con la causa de base (20). No es común que la osificación pulmonar se aprecie en las radiografías de tórax y, cuando está presente, se manifiesta como infiltrado reticulonodular en los lóbulos inferiores, generalmente bilateral. En la mayoría de los casos es difícil determinar si las imágenes lineales corresponden a áreas calcificadas o a fibrosis pulmonar, pues las líneas son muy finas. En la tomografía de alta resolución de tórax, en la variedad dendriforme, pueden verse líneas de 1 a 4 mm en un patrón arboriforme de distribución broncovascular, que denotan el compromiso intersticial, y en la variedad nodular, múltiples áreas de micronódulos subpleurales. La gammagrafía ósea con marcador radiactivo (metilen-difosfonato nuclear con tecnecio 99) permite el diagnóstico cuando se observa un aumento de la captación del trazador en ambos campos pulmonares (21).
Tanto en la hemosiderosis como en la osificación pulmonar, las pruebas de función pulmonar muestran anomalías restrictivas e hipoxemia (22). Durante los episodios de sangrado agudo en la hemosiderosis pulmonar, la hemoglobina de los eritrocitos vertida en los alvéolos absorbe ávidamente el monóxido de carbono, lo cual permite su difusión en concentraciones inusitadamente altas. Cuando se degradan los eritrocitos alveolares y la hemoglobina que contienen, la difusión del monóxido de carbono disminuye a los niveles previos a la hemorragia y sigue reduciéndose progresivamente cuando se ha desarrollado la fibrosis del parénquima pulmonar.
Se presenta un paciente con diagnóstico de hemosiderosis y osificación pulmonar, confirmado mediante estudio de histopatología, que presentaba un trastorno de base que comprometía el metabolismo del hierro. El paciente había tenido un deterioro funcional respiratorio progresivo, sin que se hubiera tenido sospecha clínica de su condición, a pesar de la cronicidad de los síntomas respiratorios.
Las autoras declaramos que no tenemos ningún interés comercial o asociativo que implique un conflicto de intereses con el trabajo presentado.
Para el presente trabajo no se requirió financiación.
Correspondencia:
Ana Madeleine Barrera, Carrera 13 B N° 161-85, Bogotá, D.C., Colombia
Teléfonos: (571) 742 8 900, 742 8888, 313 291 8534 barmadeleine@gmail.com
1. Caballero AM, Guzmán AC, Escobar RA. Enfoque inicial del paciente con hemorragia alveolar difusa sin vasculitis pulmonar. Rev Colomb Neumol. 2012;23:118-23.
2. Ceelen W. Die Krieslaufstorungen der Lungen. In: Handbuch der Spezielleu Pathologischen Anatomie Und Histologie. Berlín: Springer; 1931.
3. Fernández-Crisosto C, Quercia-árias O, Bustamante N, Moreno H, Uribe-Echevarría A. Osificación pulmonar difusa asociada a fibrosis pulmonar idiopática. Arch Bronconeumol. 2004;40:595-8. http://dx.doi.org/10.1157/13068803
4. Ioachimescu OC, Sieber S, Kotch A. Idiopathic pulmonary hemosiderosis revisited. Eur Respir J. 2004;24(1):162-70.
5. Wellington Alves dos SJ, Abdias Baptista de MN, Cardoso MR, Trindade MG, Leal FA, Gonçalves Marques TL, et al. Pulmonary hemosiderosis associated with celiac disease: Improvement after a gluten-free diet. J Bras Pneumol. 2012;38: 412-4. http://dx.doi.org/10.1590/S1806-37132012000300020
6. Milman N, Pedersen FM. Idiopathic pulmonary haemosiderosis. Epidemiology, pathogenic aspects and diagnosis. Respir Med. 1998;92:902-7. http://dx.doi.org/10.1016/S0954-6111(98)90188-3
7. Torres R, Asenjo M, Caberlotto O, Scarinci M, Lancellotti D, Tabaj G, et al. Hemosiderosis pulmonar idiopática en adultos. Presentación de tres casos y revisión de la bibliografía. Revista Americana de Medicina Respiratoria 2010;10:112-20.
8. Marchioril E, Souza A, Franquet T, Muller N. Diffuse high-attenuation pulmonary abnormalities: A pattern-oriented diagnostic approach on high-resolution CT. Am J Roentgenol. 2005;184:273-82. http://dx.doi.org/10.2214/ajr.184.1.01840273
9. Kocakoc E, Kiris A, Sen Y, Bozgeyik Z. Pediatric idiopathic pulmonary hemosiderosis diagnosed by sputum analysis: Plain radiography and computed tomography findings. Med Princ Pract. 2003;12:129-32. http://dx.doi.org/10.1159/000069112
10. Priftis KN, Anthracopoulos MB, Tsakanika C, Tapaki G, Ladis V, Bush A, et al. Quantification of siderophages in bronchoalveolar fluid in transfusional and primary pulmonary hemosiderosis. Pediatr Pulmonol. 2006;41:972-7. http://dx.doi.org/10.1002/ppul.20479
11. Willms H, Gutjahr K, Juergens UR, Hammerschmidt S, Gessner C, Hoheisel G, et al. Die idiopathische pulmonale hämosiderose. Med Klin (Munich). 2007;102:445-50. http://dx.doi.org/10.1007/s00063-007-1057-9
12. Abbdallah FCB, Amel C, Ridha M, Olfa S, Sophia T, Faouzi M, et al. Idiopathic pulmonary hemosiderosis in adult. Respir Med. 2010;3:238-40. http://dx.doi.org/10.1016/j.rmedc.2009.10.004
13. Chen CH, Yang HB, Chiang SR, Wang PC. Idiopathic pulmonary hemosiderosis: Favorable response to corti-costeroids. J Chin Med Assoc. 2008;71:421-4. http://dx.doi.org/10.1016/S1726-4901(08)70094-7
14. Airaghi L, Ciceri L, Giannini S, Ferrero S, Meroni PL, Tedeschi A. Idiopathic pulmonary hemosiderosis in an adult. Favourable response to azathioprine. Monaldi Arch Chest Dis. 2001;56:211-3.
15. Flanagan F, Glackin L, Slattery DM. Successful treatment of idiopathic pulmonary capillaritis with intravenous cyclo-phosphamide. Pediatr Pulmonol. 2013;48:303-5. http://dx.doi.org/10.1002/ppul.22583
16. Duarte IG, Gal AA, Mansour KA, Lee RB, Miller JI. Pathologic findings in lung volume reduction surgery. Chest. 1998;113:660-4. http://dx.doi.org/10.1378/chest.113.3.660
17. Heredia F, Pérez JM, Varón H, González M, Torres C, Ojeda P. Idiopathic pulmonary ossification. Revista Colombiana de Neumología. 2003;15:64-8.
18. Chan ED, Morales DV, Welsh CH, McDermott MT, Schwarz MI. Calcium deposition with or without bone formation in the lung. Am J Respir Crit Care Med. 2002;165:1654-69. http://dx.doi.org/10.1164/rccm.2108054
19. Luschka H. Verastigeknochenbildungim parenchyma der lung. Virchows Arch. 1856;10:500-5.
20. Jaderborg JM, Dunton RF. Rare clinical diagnosis of dendriform pulmonary ossification. Ann Thorac Surg. 2001;71:2009-11. http://dx.doi.org/10.1016/S0003-4975(00)02264-5
21. Saks DA, McClees EC, Fajman WA, Hollinger WM, Gilman MJ. Diffuse pulmonary ossification detected by bone scanning with Tc-99m hydroxymethylene diphosphate. Clin Nucl Med. 1984;9:594-5.
22. Allue X, Wise MB, Beaudry PH. Pulmonary function studies in idiopathic pulmonary hemosiderosis in children. Am Rev Respir Dis. 1973;107:410-5.