Biomédica 2017;37(Supl.2):215-23
doi: https://doi.org/10.7705/biomedica.v34i2.3382
COMUNICACIÓN BREVE
1 Programa de Estudio y Control de Enfermedades Tropicales, Universidad de Antioquia, Medellín, Colombia
2 Grupo de Investigación en Sistemática Molecular y Biología de Insectos, Universidad Nacional de Colombia, Medellín, Colombia
Contribución de los autores:
Rafael J. Vivero: diseño del estudio, muestreos en campo, identificación clásica y molecular, análisis de datos y escritura del manuscrito
María Angélica Contreras: identificación molecular
Juan D. Suaza: muestreos en campo y escritura del manuscrito
Iván D. Vélez: diseño del estudio y escritura del manuscrito
Charles Porter: diseño del estudio, identificación clásica y molecular, y escritura del manuscrito
Sandra I Uribe: diseño del estudio, análisis de datos y escritura del manuscrito
Recibido: 18/07/17; aceptado: 12/09/17
Introducción. Los departamentos de Chocó y Antioquia en Colombia presentan condiciones climáticas y de vegetación que favorecen el establecimiento de especies de vectores del género Lutzomyia y la transmisión de Leishmania spp. a poblaciones humanas que ingresan a ambientes selváticos conservados.
Objetivo. Reportar las especies de flebotomíneos presentes en tres reservas naturales de las regiones del Darién y del Pacífico en Colombia.
Materiales y métodos. Los flebotomíneos se recolectaron en las reservas naturales El Aguacate(Acandí, Chocó), Nabugá (Bahía Solano, Chocó) y Tulenapa (Carepa, Antioquia). La recolección se hizo con trampas de luz CDC, mediante búsqueda activa en sitios de reposo y con trampas Shannon. La determinación taxonómica de especies se basó en las claves taxonómicas. En algunas especies de interés taxonómico, se evaluó el uso de secuencias parciales de la región 5’ del gen COI.
Resultados. Se recolectaron 611 flebotomíneos adultos: 531 en Acandí, 45 en Carepa y 35 en Bahía Solano. Se identificaron 17 especies del género Lutzomyia, tres del género Brumptomyia y una del género Warileya. Las distancias genéticas (K2P) y los soportes de agrupación (>99 %) en el dendrograma de neighbor joining correspondieron a la mayoría de unidades taxonómicas operacionales moleculares (Molecular Operational Taxonomic Units, MOTU) establecidas para el grupo Aragaoi y confirmaron claramente la identidad de Lu. coutinhoi.
Conclusión. Se identificaron especies que tienen importancia en la transmisión de la leishmaniasis en Acandí, Bahía Solano y Carepa. Se confirmó la presencia de Lu. coutinhoi en Colombia.
Palabras clave: Psychodidae; Leishmania; reservas naturales, Colombia.
doi: https://doi.org/10.7705/biomedica.v34i2.3382
Species of sand flies (Diptera: Psychodidae) collected from natural reserves in the Pacific and Darien regions of Colombia
Introduction: The departments of Chocó and Antioquia in Colombia show climatic and vegetation conditions favoring the establishment of vector species of the genus Lutzomyia and the transmission of Leishmania spp. to human populations entering conserved forest environments.
Objective: To report the species of Phlebotomine sandflies present in three natural reserves in the Darien and Pacific regions of Colombia.
Materials and methods: Sand flies were collected specifically in the natural reserves El Aguacate (Acandí, Chocó), Nabugá (Bahía Solano, Chocó) and Tulenapa (Carepa, Antioquia). Sand flies were collected with CDC light traps, active search in resting places and Shannon traps. The taxonomic determination of species was based on taxonomic keys. For some species of taxonomic interest, we evaluated the partial sequences of the 5’ region of COI gene.
Results: A total of 611 adult sand flies were collected: 531 in Acandí, 45 in Carepa and 35 in Bahía Solano. Seventeen species of the genus Lutzomyia, three of the genus Brumptomyia and one of the genus Warileya were identified. The genetic distances (K2P) and grouping supported (>99%) in the neighbor joining dendrogram were consistent for most established molecular operational taxonomic units (MOTU) of the Aragaoi group and clearly confirmed the identity of Lu. coutinhoi.
Conclusion: Species that have importance in the transmission of leishmaniasis in Acandí, Bahía Solano and Carepa were identified. The presence of Lu. coutinhoi was confirmed and consolidated in Colombia.
Key words: Psychodidae; Leishmania; natural reservations, Colombia.
doi: https://doi.org/10.7705/biomedica.v34i2.3382
El conocimiento de la distribución y la presencia de insectos vectores del género Lutzomyia es fundamental para alertar sobre el riesgo de transmisión de leishmaniasis en diferentes regiones de Colombia (1,2) cuyas características ecológicas son propicias para el establecimiento de los vectores y de la cadena epidemiológica de la enfermedad (3,4). En este contexto, las poblaciones de insectos vectores de los ecosistemas tropicales son dinámicas tanto en el espacio como en el tiempo (5), aspecto que debe considerarse con especial atención en los estudios ecoepidemiológicos para el diseño de estrategias de prevención y control de las poblaciones del género Lutzomyia y de la trasmisión de la enfermedad (6).
El género Lutzomyia incluye gran diversidad de especies con características morfológicas particulares cuyo papel en la transmisión es, por lo general, específico de cada especie (4,7), razón por la cual su determinación taxonómica es crucial para entender aspectos biológicos y ecológicos que determinan patrones y dinámicas espacio-temporales de las enfermedades que transmiten (1,8).
Los efectos del cambio climático, la urbanización desorganizada y la expansión de la frontera agrícola han influido de manera considerable en el incremento de los casos de leishmaniasis y en la circulación de diferentes especies del parásito Leishmania (Le. panamensis, Le. braziliensis), por lo cual se hace necesario desarrollar estudios de vigilancia de los reservorios y de los insectos vectores del género Lutzomyia (9-13).
En los departamentos de Chocó y Antioquia se ha registrado hasta la fecha, aproximadamente, el 50 % de la fauna de flebotomíneos de Colombia, así como la presencia de un gran número de especies de vectores como Lutzomyia gomezi, Lu. panamensis, Lu. longipalpis, Lu. trapidoi y Lu. evansi,entre otras, que se han encontrado naturalmente infectadas (2,14,15).
Aunque en estos departamentos se han estudiado diversos focos de transmisión de la leishmaniasis (13), es poco el conocimiento existente sobre los insectos de importancia médica en regiones poco exploradas, como los municipios de Bahía Solano (reserva natural Nabugá) y Acandí (Chocó), los cuales tienen una gran actividad ecoturística y de extracción de madera (11). Estos factores constantemente exponen a la población humana al contacto con los vectores y a la subsecuente infección por Leishmania spp. (1). Otras áreas boscosas protegidas, como la reserva natural Tulenapa, que alberga el Centro de Desarrollo Tecnológico del Darién, ubicadas en el municipio de Carepa en Antioquia, también son de relevancia para el desarrollo de estudios biológicos de insectos vectores de leishmaniasis.
En este contexto, en el presente estudio se presenta un reporte taxonómico de flebotomíneos y especies de importancia médica presentes en tres reservas naturales de los municipios de Bahía Solano y Acandí en el Chocó, y de Carepa en Antioquia.
Materiales y métodos
área de estudio
Los muestreos entomológicos se hicieron en tres áreas de bosque conservado. La primera fue la reserva natural El Aguacate, municipio de Acandí (8°36’56,33” N, 77°19’44,69” O), en la costa Caribe del Darién chocoano (figura 1). Esta región corresponde a una zona de bosque húmedo tropical (16). Los registros mensuales de temperatura arrojan un promedio anual de 28 °C, presentándose una pequeña disminución entre los meses de enero y abril. La reserva tiene una cobertura de 200 hectáreas con fragmentos de bosque que contienen una gran diversidad de especies. Las viviendas de los colonos están construidas básicamente con madera y están separadas unas de otras por parches forestales o cultivos de iraca que fragmentan el ambiente silvestre. La población estimada es de 100 habitantes.

Entre las actividades económicas de estas dos primeras áreas de estudio, se destaca el turismo ecológico, la agricultura y la ganadería en menor escala, así como la pesca deportiva y artesanal.
La tercera área de estudio está ubicada en el municipio de Carepa (Antioquia) y es conocida como la reserva forestal Tulenapa (7°45’42,10” N, 76°39’22,57” O), la cual es una sede natural de estudios biológicos y alberga el Centro de Desarrollo Tecnológico del Darién de la Universidad de Antioquia (figura 1), con una extensión protegida de 193 hectáreas de bosque virgen no intervenido. Tulenapa es un área semiprotegida, de importancia para la vida silvestre, y presenta rasgos geológicos de especial interés para fines de conservación. La zona, localizada en la subregión del Urabá antioqueño, registra una temperatura promedio de 25 °C y su humedad relativa es de 93 % (17). La principal actividad económica de la región es la explotación intensiva de banano.
Recolección, procesamiento e identificación de flebotomíneos
Los muestreos entomológicos se hicieron durante tres días consecutivos. En Bahía Solano, se efectuaron entre el 5 y el 8 de mayo del 2012; en Acandí, entre el 2 y el 5 de noviembre de 2011, y en Carepa, del 3 al 6 de febrero de 2013.
Para la recolección se emplearon ocho trampas de luz CDC, activadas entre las 17:00 y las 06:00 h (18). También, se hizo búsqueda activa entre las 05:00 y las 10:00 horas con aspirador bucal para la recolección de adultos en reposo sobre raíces tabulares de árboles (18). También, se hizo recolección activa con trampas de luz Shannon durante tres horas en la noche (18).
Los flebotomíneos recolectados se conservaron a -20 °C en viales de 1,5 ml debidamente codificados. Los individuos fueron procesados siguiendo el protocolo de montaje y aclaración propuesto por Young, et al. (19), en el cual se sumergen las estructuras de los adultos en una solución de lactofenol (proporción 1:1 de ácido láctico y fenol) durante 24 horas. En los montajes permanentes se empleó bálsamo de Canadá y, en los semipermanentes, láminas cóncavas con solución de lactofenol.
La determinación taxonómica de especies se basó en claves taxonómicas generadas a partir de los caracteres morfológicos del estado adulto (19-21). La recolección de los especímenes adultos se conservó en láminas portaobjetos y en alcohol etílico al 70 %, y se mantiene en la Unidad de Entomología Médica del Programa de Estudio y Control de Enfermedades Tropicales, PECET, de la Universidad de Antioquia. Se consultaron los estudios actuales sobre registros y distribución geográfica de flebotomíneos en los dos departamentos y en Colombia (2,14,15,22,23). Por último, se calculó el número absoluto y el porcentaje de individuos para cada especie, según el método de recolección y la localidad de muestreo.
Análisis genético de secuencias parciales del gen citocromo oxidasa I
Es necesario indicar que la extracción de ADN y los ensayos moleculares se hicieron exclusivamente para la verificación taxonómica de ejemplares adultos de Lu. coutinhoi, con la finalidad de confirmar su presencia en Colombia mediante un método complementario al análisis de caracteres morfológicos. El ADN se extrajo del tórax y los segmentos proxi males del abdomen utilizando el protocolo de alta concentración de sales (24). El fragmento 5’ del gen mitocondrial COI se amplificó con los iniciadores LCO1490 GGTCAACAAATCATAAAGATATTGG y HCO2198 – TAAACTTCAGGG TGACCAAAAAATCA, en las condiciones de reacción y con el perfil térmico previamente descritos (25). Los productos obtenidos se secuenciaron en ambos sentidos de la cadena de ADN.
Se estimó la variabilidad genética (sitios variables y distancias genéticas K2P) entre las secuencias del COI obtenidas de Lu. coutinhoi y las de otras especies del grupo Aragaoi. Se generó un dendrograma de distancias K2P con el método neighbor joining (NJ) para representar de forma gráfica el patrón de agrupamiento entre las distintas secuencias (26).
Lutzomyia coutinhoi presenta leves variaciones morfológicas en el aparato reproductor (genitalia) de los machos y gran similitud morfológica en el de las hembras, con respecto a otras especies del grupo Aragaoi. Aunque las claves actualizadas de Galati (21) permiten la diferenciación de estas especies, las cuales contemplan mediciones como la de los antenómeros, algunos caracteres, como la forma y la pigmentación del falo (aedeagus), la forma final de los filamentos genitales y la presencia de tufo de setas, son subjetivos.
Resultados
Se recolectaron 616 flebotomíneos adultos, la mayoría de ellos con las trampas CDC (n=585; 94,9 %), en tanto que, mediante búsqueda activa (n=10; 1,62 %) y con las trampas Shannon (n=16; 2,5 %), se recolectaron menos ejemplares (cuadro 1).
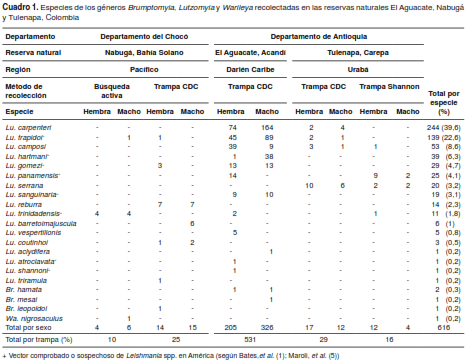
Se identificaron 21 especies distribuidas en los géneros Lutzomyia, Brumptomyia y Warileya (cuadro 1). El mayor número de especies se registró en la reserva natural El Aguacate. La especie más frecuente en esta reserva fue Lu. carpenteri (n=244; 45,9 %), en tanto que en las reservas naturales de Tulenapa y Nabugá, las más frecuentes fueron Lu. serrana (n=20; 44,4 %) y Lu. reburra (n=14; 40 %), respectivamente (cuadro 1).
En el registro de flebotomíneos obtenido en la reserva natural Nabugá (Bahía Solano), se destacó la especie Lu. coutinhoi (figura 2), hallazgo que permitió confirmar su presencia en Colombia (cuadro 1). Para consolidar este hallazgo, se analizaron los patrones morfológicos exhibidos principalmente por los machos y, para su confirmación taxonómica, se utilizaron secuencias parciales del marcador mitocondrial, el gen citocromo oxidasa I (COI), tanto en machos como en hembras. Previamente, Contreras, et al. (2), habían reportado las secuencias de nucleótidos del gen COI, pero no hicieron un análisis minucioso que validara la identidad de la especie y confirmara su presencia en Colombia.

El análisis genético de un fragmento de 527 nucleótidos del gen COI reveló 85 sitios variables de nucleótidos y 59 de aminoácidos en Lu. coutinhoi y Lu. aragaoi (figura 3a),consideradas las especies más cercanas y las que guardan mayor similitud morfológica. El número de sitios se mantuvo en el rango de variabilidad de nucleótidos de las otras especies del grupo Aragaoi contempladas en el estudio (Lu. carpenteri, Lu. runoides, Lu. aragaoi, Lu. shannoni y Lu. aclydifera).
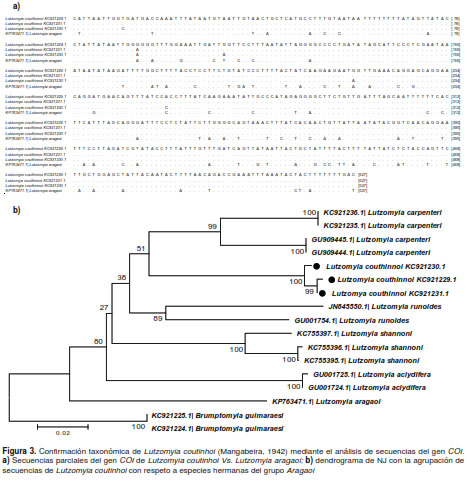
Las distancias genéticas K2P entre Lu. coutinhoi y Lu. aragaoi fluctuaron entre 0,175 y 0,180, lo cual concuerda con el rango de distancias entre especies dentro del grupo Aragaoi (K2P: 0,128 a 0,183). El dendrograma de NJ fue consistente y se respaldó utilizando el método de remuestreo bootstrap (>99 %), y reflejó de manera clara la agrupación de secuencias del COI de Lu. coutinhoi
con respecto a las demás especies (figura 3b).
Discusión
El inventario taxonómico de flebotomíneos de este estudio incluye un gran número de especies del género Lutzomyia de importancia en la transmisión de la leishmaniasis (Lu. panamensis, Lu. trapidoi, Lu. gomezi, Lu. trinidadensis, Lu. hartmani) (1), especialmente en ambientes rurales cercanos a reservas forestales asociadas con ecosistemas de bosque húmedo tropical (27-29). Entre los hallazgos más importantes se destaca, asimismo, la confirmación taxonómica de Lu. coutinhoi para Colombia. Por otra parte, la presencia de los géneros Warileya y Brumptomyia, frecuentemente asociados con una perturbación ambiental reducida, resulta útil para emplearlos como bioindicadores del estado natural de los ecosistemas (14,30,31).
Este es el primer reporte exploratorio de flebotomíneos en la reserva natural y estación experimental Tulenapa, el cual abre la posibilidad de hacer futuros estudios biológicos más sistémicos y con mayor esfuerzo de muestreo. Todas las especies recolectadas ya han sido registradas para el departamento de Antioquia (2), y solo Lu. panamensis y Lu. trinidadensis revisten importancia médica (1,32).
La fauna de flebotomíneos recolectada en la reserva El Aguacate en Acandí no evidenció diferencias sustanciales en cuanto a la riqueza de especies con respecto a estudios anteriores en la misma localidad (15). Sin embargo, sí hubo diferencias con respecto a la abundancia, pues fue menor la de Lu. panamensis y mayor la de Lu. trapidoi,lo cual sugiere una alternancia estacional (abril Vs. noviembre) asociada con las épocas de recolección y con el efecto de las variables climáticas en las poblaciones de estos insectos vectores (33,34).
Este hallazgo sugiere que Lu. trapidoi puede pasar de ser un vector secundario a ser vector primario en ausencia de Lu. panamensis,lo cual es de importancia en salud pública porque la superposición de especies de vectores y la alternancia estacional implican una mayor complejidad en los ciclos de transmisión de la leishmaniasis (35). En este sentido, es necesario precisar que Lu. trapidoi es vector de Leishmania braziliensis, L. panamensis y L.mexicana en la región del Pácifico y en el valle del río Cauca, principalmente, mientras que Lu. panamensis es vector de L. braziliensis y L. panamensis en el valle del río Magdalena y la región del Darién (1,11). Lo anterior amerita la realización de estudios sobre la infección natural en las poblaciones de Lu. trapidoi en el municipio de Acandí, para validar su estatus de vector en la región de Urabá en Colombia.
En la reserva de Nabugá (Bahía Solano) también se recolectaron varias especies de importancia en la transmisión de Leishmania (Lu. trapidoi, Lu. trinidadensis, Lu. gomezi) (1), pero uno de los principales hallazgos fue la recolección de ejemplares de Lu. coutinhoi,como confirmación de su presencia en Colombia.
Lutzomyia coutinhoi se había registrado únicamente en Brasil, Bolivia y Perú (19), y es una especie sin importancia epidemiológica. Las especies del grupo Aragaoi provenientes de diferentes localidades pueden presentar considerables variaciones en la forma, la longitud y la pigmentación de sus parámeros y del falo (aedeagus) (19,21). Sin embargo, presenta claramente un parámero y un falo (aedeagus) alargados (este último relativamente más delgado), con filamentos genitales que se diferencian claramente en cuanto a la forma en que va el espiral (figura 2a) de especies del mismo grupo, como Lu. aragaoi (figura 2d). Galati (21) ubica esta especie en el género Psathyromyia, y sugiere la ausencia de tufo de setas distales en el gonocoxito (figura 2b) y el falo (aedeagus) en forma de cono, como caracteres diagnósticos en los machos. En las hembras, la longitud del flagelómero III (210 µm) es menor que en Lu. aragaoi (320 µm) (19,21). Otro rasgo distintivo es la ausencia de ascoides en los tres últimos flagelómeros, lo cual constituye uno de los caracteres diagnósticos de Lu. coutinhoi (21) (figura 2c).
El análisis genético complementario de las secuencias del COI fue más exhaustivo en este estudio, y permitió consolidar la identificación de Lu. coutinhoi y la agrupación de sus secuencias (dendrograma NJ, figura 3b) frente al resto de especies del grupo Aragaoi, como Lu. aragaoi, Lu. carpenteri, Lu. runoides, Lu. shannoni y Lu. aclydifera (figura 3b).
Las distancias K2P entre especies concordaron con lo propuesto en diversos estudios para la diferenciación de especies de Lutzomyia (36),e indica un significativo polimorfismo de nucleótidos entre Lu. coutinhoi y Lu. aragaoi (figura 3a), especies estrechamente relacionadas. Es necesario hacer énfasis en que tres de las secuencias registradas en GenBank como Lu. aragaoi por Contreras, et al.(2), corresponden en realidad a Lu. coutinhoi.
En conclusión, el análisis integrador de los caracteres morfológicos y moleculares es indispensable para un registro más preciso de los inventarios de flebotomíneos (37), ya que las hembras de algunas especies carecen de caracteres morfológicos distintivos (38). Asimismo, es necesario llevar a cabo curadurías sistemáticas de las secuencias registradas en GenBank, sobre todo cuando provienen de áreas geográficas cuya diversidad es poco conocida.
Se espera que este trabajo sea útil para los estudios epidemiológicos y que funcione como base para futuras investigaciones taxonómicas de especies del género Lutzomyia presentes en los municipios de Carepa, Acandí y Bahía Solano. Se sugiere, además, estudiar el estatus de infección natural por Leishmania spp.en las especies de Lutzomyia de importancia médica y en los reservorios silvestres de cada localidad.
El gran número de especies de vectores de leishmaniasis cutánea representa un factor de riesgo para la población humana que interactúa de forma constante o esporádica con estos ambientes selváticos en los municipios de Acandí, Carepa y Bahía Solano.
A Jovany Barajas (PECET, Universidad de Antioquia), por su ayuda en la recolección de flebotomíneos en la reserva Nabugá, Bahía Solano. A los pobladores locales que permitieron y facilitaron las visitas de campo para la recolección de los flebotomíneos.
Grupo de Investigación en Sistemática Molecular y Biología de Insectos, Universidad Nacional de Colombia, sede Medellín; Programa de Estudio y Control de Enfermedades Tropicales, Universidad de Antioquia, Medellín.
Correspondencia:
Rafael J. Vivero Gómez, Calle 62 N° 52 - 59, laboratorio 632, Medellín, Colombia
Teléfonos: (574) 219 6502 y (300) 678 6498
rjviverog@unal.edu.co
1. Bates PA, Depaquit J, Galati EA, Kamhawi S, Maroli M, Mcdowell MA, et al. Recent advances in phlebotomine sand fly research related to leishmaniasis control. Parasit Vectors. 2015;8:131. https://doi.org/10.1186/s13071-015-0712-x
2. Contreras-Gutiérrez MA, Vélez ID, Porter CH, Uribe SI. Lista actualizada de flebotomíneos (Diptera: Psychodidae: Phlebotominae) de la región cafetera colombiana. Biomédica. 2014;34:483-98. https://doi.org/10.7705/biomedica.v34i3.2121
3. Dantas-Torres F, Tarallo VD, Latrofa MS, Falchi A, Lia RP, Otranto D. Ecology of phlebotomine sand flies and Leishmania infantum infection in a rural area of southernItaly. Acta Trop. 2014;137:67-73. https://doi.org/10.1016/j.actatropica.2014.04.034
4. Sharma U, Singh S. Insect vectors of Leishmania: Distribuition, physiology and their control. J Vector Borne Dis. 2008;45:255-72.
5. Maroli M, Khoury C. Current approaches to the prevention and control of leishmaniasis vectors. Vet Res Commun. 2006;30:49-52.
6. Nieves E, Oraá L, Rondón Y, Sánchez M, Sánchez Y, Rujano M, et al. Distribution of vector sandflies leishmaniasis from an endemic area of Venezuela. J Trop Dis Public Health. 2015;3. https://doi.org/10.4172/2329891X.1000157
7. Teixeira C, Gomes R, Collin N, Reynoso D, Jochim R, Oliveira F, et al. Discovery of markers of exposure specific to bites of Lutzomyia longipalpis, the vector of Leishmania infantum chagasi in Latin America. PLoS Negl Trop Dis. 2010;4:e638. https://doi.org/10.1371/journal.pntd.0000638
8. Bejarano EE, Sierra D, Vélez ID. Novedades en la distribución geográfica del grupo verrucarum (Diptera : Psychodidae) en Colombia. Biomédica. 2003;23:341-50. https://doi.org/10.7705/biomedica.v23i3.1228
9. Armed Forces Pest Management Board. Sand flies (Diptera: Psychodidae: Phlebotominae): Significance, surveillance, and control in contingency operations. Armed Forces Pest Manag Board. 2015;49:72.
10. Instituto Nacional de Salud. Semana epidemiológica número 45. Bogotá: INS; 2015. Fecha de consulta: 15 de diciembre de 2015. Disponible en: http://www.ins.gov.co/lineas-de-accion/Subdireccion-Vigilancia/sivigila/Paginas/vigilancia-rutinaria.aspx.
11. Duque P, Vélez I, Morales M, Sierra D. Sand flies fauna involved in the transmission of cutaneous leishmaniasis in Afro-Colombian and Amerindian communities of Chocó, Pacific Coast of Colombia. Neotrop Entomol. 2004;33:25564. https://doi.org/10.1590/S1519-566X2004000200018
12. Ovalle CE, Porras L, Rey M, Ríos M, Camargo YC. Distribución geográfica de especies de Leishmania aisladas de pacientes consultantes al Instituto Nacional de Dermatología Federico Lleras Acosta, E.S.E., 1995-2005. Biomédica. 2006;26:145-51. https://doi.org/10.7705/biomedica.v26i1.1508
13. Corredor A, Kreutzer RD, Tesh RB, Boshell J, Paláu MT, Cáceres E, et al. Distribution and etiology of leishmaniasis in Colombia. Am J Trop Med Hyg. 1990;42:206-14. https://doi.org/10.4269/ajtmh.1990.42.206
14. Vivero RJ, Muskus CE, Uribe SI, Bejarano EE, Torres C. Flebotomíneos (Diptera: Psychodidae) en la reserva natural del cañón del río Claro (Antioquia), Colombia. Actual Biol. 2010;32:165-71.
15. Vivero R, Muskus C, Torres C. Fauna of Phlebotominae (Diptera : Psychodidae) in Acandí (Chocó, Colombia). Acta Biol Colomb. 2011;16:209-17.
16. Rangel O, Arellano P. Clima del Chocó biogeográfico/Costa Pacífica de Colombia. En: Rangel O, editor. Diversidad Biótica IV. Bogotá: Universidad Nacional; 2004. p. 39-82.
17. Espinal LS. Geografía ecológica del departamento de Antioquia (zonas de vida (formaciones vegetales) del departamento de Antioquia). Fac Nac Agron. 1964;24:24-32.
18. Alexander B. Sampling methods for phlebotomine sand flies. Med Vet Entomol. 2000;14:109-22. https://doi.org/10.1046/j.1365-2915.2000.00237.x
19. Young DG, Duncan M. Guide to the identification and geographic distribution of Lutzomyia sand flies in México, the West Indies, Central and South America (Diptera: Psychodidae). J Biol Sci. 1994;14:79-94.
20. Ibáñez-Bernal S. Phlebotominae (Diptera: Psychodidae) de México. VI. Clave ilustrada para la identificación de las hembras de Lutzomyia,França. Folia Entomol Mex. 2005;44:195-212.
21. Galati EA. Phlebotominae (Diptera, Psychodidae) Classificação, morfologia, terminologia e identificação de adulto. En: Rangel EF, Lainson R, editor. Flebotomíneos do Brasil. Rio de Janeiro: Editora Fiocruz; 2016. p. 367.
22. Bejarano EE, Uribe SI, Pérez-Doria A, Egurrola J, Dib JC, Porter CH. New records of Phlebotomine sand flies (Diptera: Psychodidae) at Sierra Nevada de Santa Marta, Colombia. Acta Biol Colomb. 2015;20:221-4.
23. Estrada LG, Aponte OA, Bejarano EE. New records of species of Lutzomyia (Diptera : Psychodidae) from the department of Cesar, Colombia. Acta Biol Colomb. 2015;20:225-8.
24. Vivero RJ, Contreras-Gutiérrez MA, Bejarano EE. Análisis de la estructura primaria y secundaria del ARN de transferencia mitocondrial para serina en siete especies de Lutzomyia. Biomédica. 2007;27:429-38. https://doi.org/10.7705/biomedica.v27i3.205
25. Hebert P, Cywinska A, Ball S, DeWaard J. Biological identifications through DNA barcodes. Proc Biol Sci. 2003;270:313-21. https://doi.org/10.1098/rspb.2002.2218
26. Hajibabaei M, Singer GA, Hebert PD, Hickey DA. DNA barcoding: How it complements taxonomy, molecular phylo-genetics and population genetics. Trends Genet. 2007;23:167-72. https://doi.org/10.1016/j.tig.2007.02.001
27. Dutari LC, Loaiza JR. American cutaneous leishmaniasis in Panamá: A historical review of entomological studies on anthropophilic Lutzomyia sand fly species. Parasit Vectors. 2014;7:218. https://doi.org/10.1186/1756-3305-7-218.
28. Le Ponti F, León R, Guerrini F, Gantier JC, Mouchet J, Echeverría R, et al. Leishmaniasis in Ecuador: Lutzomyia trapidoi, vector of Leishmania panamensis. Ann Soc Belg Med Trop. 1994;74:23-8.
29. Saldaña A, Chaves LF, Rigg CA, Wald C, Smucker JE, Calzada JE. Clinical cutaneous leishmaniasis rates are associated with household Lutzomyia gomezi, Lu. panamensis, and Lu. trapidoi abundance in Trinidad de Las Minas, Western Panamá. Am J Trop Med Hyg. 2013;88:572-4. https://doi.org/10.4269/ajtmh.12-0579
30. Barreto M, Burbano ME. New geographic records of Warileya and Brumptomyia (Diptera : Psychodidae) in South Western Colombia. Acta Biol Col. 2007;12:143-8.
31. Vivero RJ, Bejarano EE, Castro M, Vélez A, Pérez JE, Pérez-Doria A, et al. Trece registros nuevos de Lutzomyia (Diptera : Psychodidae) para el departamento de Vichada, Orinoquia colombiana. Biota Neotrop. 2010;10:401-4.
32. Salomon O. Vectores de leishmaniasis en Las Américas. Gazeta Médica da Bahia. 2009;79:3-15.
33. Montoya-Lerma J, Cadena H, Oviedo M, Ready PD, Barazarte R, Travi BL, et al. Comparative vectorial efficiency of Lutzomyia evansi and Lu. longipalpis for transmitting Leishmania chagasi. Acta Trop. 2003;85:19-29. https://doi.org/10.1016/S0001-706X(02)00189-4
34. Souza NA, Andrade-Coelho CA, Vilela ML, Peixoto AA, Rangel EF. Seasonality of Lutzomyia intermedia and Lutzomyia whitmani (Diptera: Psychodidae: Phlebotominae), occurring sympatrically in area of cutaneous leishmaniasis in the State of Rio de Janeiro, Brazil. Mem Inst Oswaldo Cruz. 2002;97:759-65. https://doi.org/10.1590/S0074-02762002000600001
35. Ferro C, López M, Fuya P, Lugo L, Cordovez JM, González C. Spatial distribution of sand fly vectors and eco-epidemiology of cutaneous leishmaniasis transmission in Colombia. PLoS One. 2015;10:1-16.
36. Gutiérrez MA, Vivero RJ, Vélez ID, Porter CH, Uribe S. DNA barcoding for the identification of sand fly species (Diptera, Psychodidae, Phlebotominae) in Colombia. PLoS One. 2014;9:e85496. https://doi.org/10.1371/journal.pone.0085496
37. Island C, Azpurua J, Cruz DD, Valderrama A, Windsor D. Lutzomyia sand fly diversity and rates of infection by Wolbachia and an exotic Leishmania species on Barro Colorado Island, Panamá. PLoS Negl Trop Dis. 2010;4:e627. https://doi.org/10.1371/journal.pntd.0000627
38. Kuwahara K, Kato H, Gómez EA, Uezato H, Mimori T, Yamamoto Y, et al. Genetic diversity of ribosomal RNA internal transcribed spacer sequences in Lutzomyia species from areas endemic for New World cutaneous leishmaniasis. Acta Trop. 2009;112:131-6. https://doi.org/10.1016/j.actatropica.2009.07.010