Biomédica 2017;37(Supl.2):224-43
doi: https://doi.org/10.7705/biomedica.v34i2.3475
REVISIÓN DE TEMA
1 Escuela Nacional de Ciencias Biológicas, Instituto Politécnico Nacional, Ciudad de México, México
2 Facultad de Ciencias Químicas, Universidad Autónoma de Chihuahua, Chihuahua, México
Contribución de los autores:
Alejandro D. Camacho: diseño del trabajo, revisión sistematica de la actividad biológica de los aceites esenciales y revisión del manuscrito
Benjamín Nogueda-Torres: diseño del trabajo, revisión sistemática de la actividad de los componentes
Alejandro D. Camacho: revisión sistematica de la actividad biológica de los aceites esenciales y revisión del manuscrito
Guadalupe Virginia Nevárez-Moorillón: revisión sistematica de la actividad biológica de los aceites esenciales, revisión de los estudios de simulación computacional y modelado molecular de los sesquiterpenos y dianas biológicas, y revisión del manuscrito
Luvia E. Sánchez-Torres: revisión sistemática de la actividad de los componentes y escritura del manuscrito
Sergio Andrade-Ochoa participó en todas las étapas del estudio.
Recibido: 30/08/16; aceptado: 27/04/17
Más de la mitad de la población humana está expuesta a contraer infecciones transmitidas por mosquitos. El cambio climático y la aparición de cepas resistentes a los insecticidas tradicionalmente utilizados han motivado la búsqueda de nuevos agentes capaces de controlar las poblaciones de mosquitos. Los aceites esenciales han resultado ser eficaces agentes repelentes y larvicidas.
El objetivo de este trabajo fue revisar las investigaciones llevadas a cabo en los últimos años sobre la actividad larvicida de los aceites esenciales y sus componentes contra mosquitos de los géneros Aedes, Anopheles y Culex, así como los últimos reportes sobre su posible mecanismo de acción.
Palabras clave: aceites volátiles; insectos vectores; vectores de enfermedades; larvicidas; terpenos.
doi: https://doi.org/10.7705/biomedica.v34i2.3475
Essential oils and their components as an alternative in the control of mosquito vectors of disease
More than half of the human population is exposed to mosquito-borne infections. Climate change and the emergence of strains resistant to traditionally used insecticides have motivated the search of new agents for mosquito population control. Essential oils have been effective repellents and larvicidal agents.
The aim of this work was to review research studies conducted in recent years on the larvicidal activity of essential oils and their components against Aedes, Anopheles and Culex mosquitoes, as well as the latest reports about their possible mechanism of action.
Key words: Oils, volatile; insect vectors; disease vectors; larvicides; terpenes.
doi: https://doi.org/10.7705/biomedica.v34i2.3475
Más de la mitad de la población humana está expuesta a contraer infecciones transmitidas por mosquitos. La falta de tratamientos y vacunas eficaces para muchas de estas enfermedades hace que su control dependa principalmente de la utilización de agentes insecticidas (1). Los individuos que habitan en las áreas tropicales están más expuestos a contraer enfermedades transmitidas por vectores y este riesgo ha aumentado en otras zonas debido a la globalización (2).
Culex, Aedes y Anopheles son vectores de diversas enfermedades, como la filariasis, el dengue, la malaria, y otras. Culex quinquefasciatus está presente en vastas regiones tropicales del mundo, es la principal plaga doméstica en muchas áreas urbanas y está implicada en la transmisión de muchos agentes patógenos, entre ellos, el causante de la filariasis linfática. Esta enfermedad está ampliamente distribuida en las zonas tropicales, con alrededor de 120 millones de personas infectadas en todo el mundo (3).
Aedes aegypti es el principal vector del dengue clásico y el dengue hemorrágico. La incidencia del dengue ha aumentado 30 veces en las últimas décadas y cerca de dos quintas partes de la población mundial está ahora en riesgo (4). Se estima que unos 2,5 millones de personas viven en más de 100 países endémicos y que 50 millones de infecciones se producen anualmente (5). Los mosquitos del género Aedes también pueden transmitir otros virus, como el del Nilo Occidental, del cual ya se han reportado varios casos de infección en el continente americano (6), así como la fiebre de chikungunya, producida por un alfavirus en expansión geográfica (7,8) y la enfermedad causada por el virus Zika, el cual es un flavivirus que se transmite tanto en áreas urbanas como selváticas.
La malaria, o paludismo, es una enfermedad causada por parásitos del género Plasmodium que se transmiten a las personas por la picadura del mosquito Anopheles. Según las últimas estimaciones, 198 millones de casos de malaria se produjeron a nivel mundial en el 2013 y la enfermedad dio lugar a 584.000 muertes (9). Béguin, et al., han pronosticado que más de 200 millones de individuos estarán en riesgo para el 2050 debido al acelerado cambio climático y la lentitud en el desarrollo socioeconómico de los países del tercer mundo (10), los cuales se ubican principalmente en las zonas endémicas, por lo que es claro que las actividades del hombre y las alteraciones en la biodiversidad de los ecosistemas afectan de manera significativa el número y el movimiento de las especies de reservorios y vectores, y, en consecuencia, la incidencia de las enfermedades transmitidas por vectores en humanos (11).
Es evidente que el cambio climático representa un grave problema al aumentar los rangos geográficos de riesgo de las enfermedades transmitidas por vectores. La Organización Mundial de la Salud (OMS) ha estimado que, si las temperaturas globales se incrementan de 2 a 3 °C para el 2030, como se espera, la población en riesgo de infectarse con malaria, por ejemplo, aumentará de 3 a 5 % (12). Por otro lado, el uso intensivo de insecticidas sintéticos en el control de los mosquitos ha generado muchos problemas y ha tenido un impacto negativo en el medio ambiente, así como resistencia (13), con efectos indeseables sobre organismos no específicos y sobre la vida silvestre (14,15).
La resistencia de los mosquitos a los insecticidas se ha reportado en todo el mundo, como puede comprobarse por los hallazgos en Tanzania (16), Grecia (17), México (18), Tailandia (19) y Colombia (20), por mencionar solo algunos países. Debido a la alta incidencia de cepas resistentes a los insecticidas tradicionalmente utilizados, hoy se buscan nuevos métodos para el control de los mosquitos. Los productos naturales de origen vegetal con actividad insecticida potencial, se consideran alternativas válidas frente a los pesticidas sintéticos convencionales en el control de una amplia variedad de insectos, plagas y vectores.
A lo largo de la historia, las plantas y los insectos han coexistido y evolucionado en paralelo. Las plantas han aprovechado a los insectos como agentes polinizadores, pero también han tenido que desarrollar mecanismos de defensa contra insectos depredadores (21). En este contexto, los aceites esenciales y sus componentes se destacan como compuestos potencialmente útiles contra los insectos (22,23).
Aceites esenciales y su composición química
Los aceites esenciales son sustancias de origen vegetal cuyas mezclas de metabolitos secundarios volátiles, insolubles en agua, les confieren características particulares según sus diferentes proporciones (24). Estos aceites se originan en los tejidos secretores de las plantas y, por lo general, son líquidos a temperatura ambiente, más ligeros que el agua, de olor fuerte y penetrante que recuerda su planta de origen, e incoloros o de color amarillo traslúcido (25).
Su función es variada en las plantas: son agentes de polinización y sirven de reserva y de protección, ya que defienden a la planta de otras plantas, de algunos insectos y de microorganismos. Los aceites esenciales se clasifican con base en diferentes criterios: su consistencia, su origen y la composición química de sus componentes mayoritarios (26).
En cuanto a su composición química, se encuentran principalmente terpenos y fenilpropanos, a partir de los cuales se pueden constituir aldehídos, alcoholes, ésteres y cetonas, entre otros. Estos compuestos son los responsables de la fragancia y las propiedades biológicas de los aceites esenciales. Es importante resaltar que 85 % de estos aceites suele tener uno o dos compuestos mayoritarios, mientras que el resto de su composición consiste en decenas de compuestos minoritarios (24,25).
Los aceites esenciales se han estudiado ante todo como agentes antimicrobianos. El de orégano, por ejemplo, se ha analizado ampliamente por su actividad contra bacterias Gram positivas y Gramnegativas (27), así como contra hongos filamentosos, levaduras y protozoarios (28,29).
Como ya se mencionó, los aceites esenciales pueden ser una fuente alternativa de agentes de control de mosquitos y otros insectos, ya que son ricos en compuestos con actividad biológica, son biodegradables y se transforman en productos no tóxicos, son amigables con el medio ambiente y están potencialmente adecuados para su uso en los programas de control integral (21,30,31). De hecho, muchos investigadores han informado sobre la eficacia de los aceites esenciales como agentes contra larvas y ejemplares adultos y, asimismo, como repelentes (14,23,30-32).
En este contexto, el propósito de este trabajo fue revisar y evaluar las investigaciones llevadas a cabo en los últimos años sobre la actividad larvicida de los aceites esenciales y sus componentes, así como los últimos reportes sobre sus posibles mecanismos de acción y los estudios hechos mediante modelado molecular. A continuación se presenta la actividad biológica contra las larvas de mosquitos de 81 aceites esenciales y 68 de sus moléculas.
Actividad larvicida de los aceites esenciales
Desde hace décadas se vienen utilizando diversas partes de las plantas y sus extractos como agentes repelentes e insecticidas contra distintas especies de insectos (30). El limoneno y el carvacrol, por ejemplo, son dos terpenos utilizados frecuentemente como insecticidas, en tanto que el aceite esencial de eucalipto se ha empleado ampliamente como repelente natural de insectos (31).
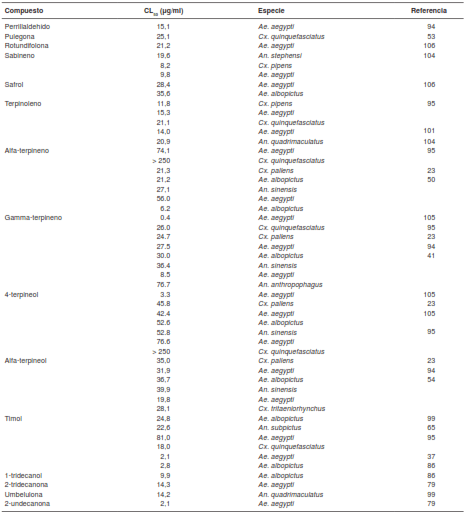
La actividad larvicida de los aceites esenciales y sus componentes generalmente se evalúan con el método propuesto por la OMS en el 2005 para estandarizar los procedimientos de evaluación de la actividad larvicida en el laboratorio y en campo (33). Varios autores han desarrollado sus propios criterios sobre lo que se considera un agente larvicida, pero la mayoría coincide en que un producto vegetal puede considerarse como un larvicida eficaz solo si tiene una concentración letal 50 (CL50 ) por debajo de los 100 µg/ml (ppm) (32).
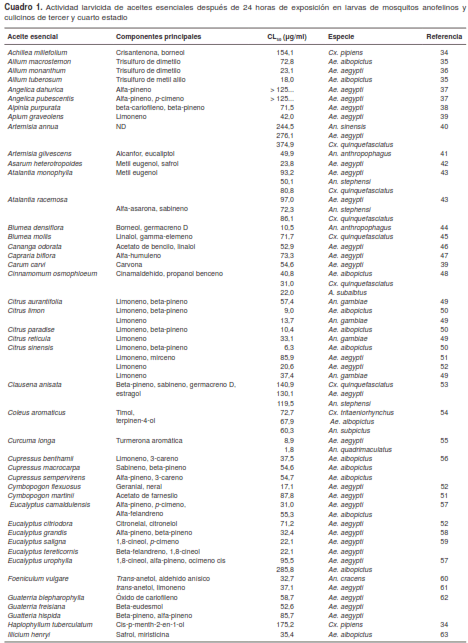
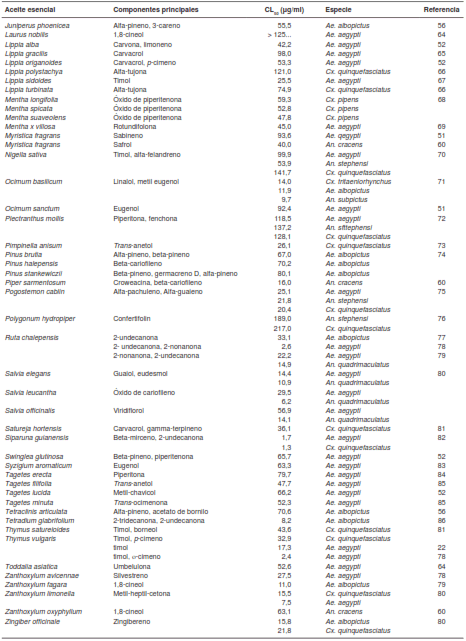
En el cuadro 1 se presenta la actividad de 81 aceites esenciales a las 24 horas de exposición en larvas de tercer y cuarto estadios. Los criterios de búsqueda fueron las palabras clave “actividad larvicida” y “aceites esenciales”, y se incluyeron todos los reportes de actividad sobre Culex, Aedes y Anopheles publicados entre 2010 y 2015. La búsqueda se llevó a cabo en las bases de datos de Science Direct, Scientific Electronic Library Online y Google Scholar.

Los aceites esenciales de plantas pertenecientes a las familias botánicas Lamiaceae, Myrtaceae y Poaceae se han reportado ampliamente como agentes repelentes y larvicidas (87). Gillij, et al., demostraron que los aceites esenciales extraídos de catorce plantas tenían efecto repelente y larvicida contra Ae. aegypti (88).
Distintos extractos de Cymbopogon se han utilizado tradicionalmente para repeler a los mosquitos (89). Este género produce los repelentes naturales más utilizados en el mundo (87). La actividad larvicida de C. flexuosus y C. martinii se ha evaluado en larvas de Ae.aegypti, con una CL50 de 17,1 y 87,88 µg/ml, respectivamente (51,52). Los aceites esenciales del género Cymbopogon se caracterizan por tener altas concentraciones de geraniol y sus derivados.
Los de Ocimum spp. también se han utilizado tradicionalmente como repelentes (90). En O. basilicum se ha demostrado una actividad larvicida relevante. Govindarajan, et al., reportaron que este aceite esencial tiene una CL50 menor de 15 µg/ml contra larvas de Ae. albopictus, An. subpictus y Cx. tritaeniorhynchus,en tanto que el de Ocimum sanctum registra una CL50 mayor de 90 µg/ml (51).
Las propiedades repelentes y larvicidas del género Eucalyptus spp. contra mosquitos y otros artrópodos dañinos están bien documentadas (91). El aceite esencial de Eucalyptus globulus,por ejemplo,posee actividad larvicidacontra Ae. aegypti (43), y los de E. gunii, E. saligna y E. tereticornis han presentado una CL50 cercana a 20 µg/ml (59). Por otro lado, el aceite esencial de E. citriodora no registra una buena actividad repelente contra Ae. aegypti,pero sí contra An. dirus y Cx. quinquefasciatus (92), y los de E. urophylla y E. citriodora no poseen actividad larvicida relevante (52,57), lo cual pone de manifiesto que la actividad larvicida no se presenta siempre y que, incluso, puede depender del sexo.
Los aceites esenciales extraidos del género Cinnamomum poseen una importante actividad larvicida; de hecho, se ha reportado que el de C. zeylanicum es el de mayor actividad repelente, pues en una concentración de 0,11 µg/cm2 logra repeler el 100 % de los mosquitos de An. stephensi y Cx. quinquefasciatus durante ocho horas, aproximadamente (93). Por lo general, el cinamaldehído es el componente mayoritario de los aceites esenciales de este género. A este fenilpropano se le han atribuido varios tipos importantes de actividad biológica (48).
También se ha comprobado una relevante actividad larvicida en los cítricos. Los aceites esenciales de Citrus limon y C. sinensis son los de mayor acti vidad larvicida en Ae. albopictus, con una CL50 de 9,08 y 6,33 µg/ml, respectivamente (50). El aceite esencial de C. sinensis se ha estudiado ampliamente, y en las publicaciones revisadas se registra una tendencia a la resistencia de Ae. aegypti a dicho aceite (51). La mayoría de los autores han propuesto que la actividad presente en los aceites esenciales del género Citrus se debe al limoneno, el terpeno más abundante en ellos (48,52).
Existen varios informes de que los compuestos 2-undecanona y 2-nonanona son los mayoritarios en el aceite esencial de Ruta chalepensis y los responsables de su actividad repelente y larvicida. A una concentración de 0,080 µg/cm , este aceite tiene un porcentaje de repelencia de 90 % y un tiempo de protección de 90 minutos (77), y varios autores han demostrando su eficacia como repelente y larvicida contra Ae. aegypti y An.quadrimaculatus (78).
Los aceites esenciales con mayor actividad larvicida reportada en la presente revisión fueron los de Curcuma longa y Siparuna guianensis. Ali, et al., reportaron que el aceite esencial de C. longa tiene una CL50 de 1,8 µg/ml contra An. quadrimaculatus y que la turmerona aromática es su compuesto mayoritario (55). Por su parte, Aguiar, et al., reportaron una CL50 de 1,76 y 1,36 µg/ml contra Ae. aegypti y Cx. quinquefasciatus, respectivamente, con el aceite esencial de S. guianensis, el cual está principalmente constituido por beta-mirceno y 2-undecanona (82). Por otro lado, los aceites esenciales con menor actividad larvicida fueron los de Achillea millefolium, Angelica dahurica, Angelica pubescentis, Artemisia annua, Clausena anisata, Coriandrum sativum, Croton heliotropiifolius, Haplophyllum tuberculatum, Laurus nobilis, Plectranthus mollis y Polygonum hydropiper, todos ellos con actividades mayores de 100 µg/ml (34,40,53,72).
Como ya se mencionó, los aceites esenciales son mezclas complejas, y su actividad repelente y larvicida se ha correlacionado, por lo general, con sus componentes mayoritarios. Sin embargo, es bien conocido que todos sus componentes pueden interactuar y modular la actividad biológica (94).
Actividad larvicida de las moléculas puras y efecto de sinergia y antagonismo
Los reportes sobre la actividad repelente y larvicida de los componentes puros son más escasos en comparación con los relacionados con los aceites esenciales. En la presente revisión, se recopilaron informes sobre la actividad larvicida de 68 componentes de diversos aceites esenciales (cuadro 2) y en la figura 1 se pueden observar las estructuras químicas de las moléculas con mayor actividad larvicida.
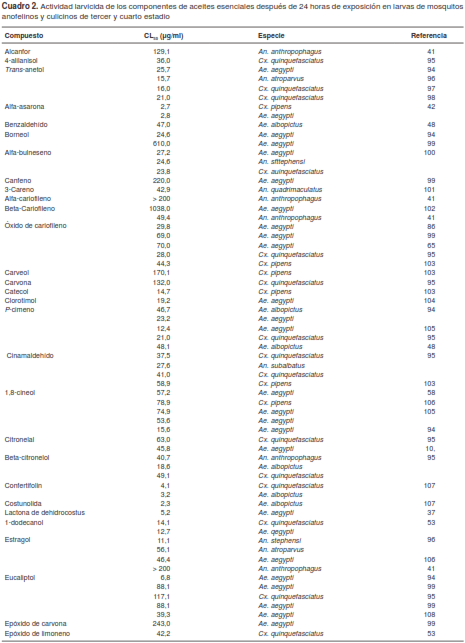
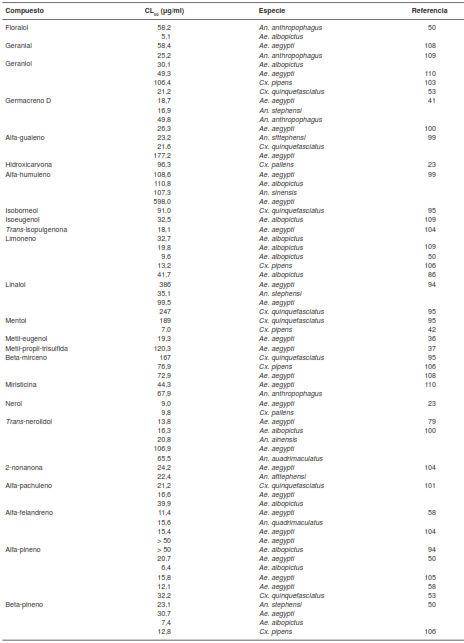
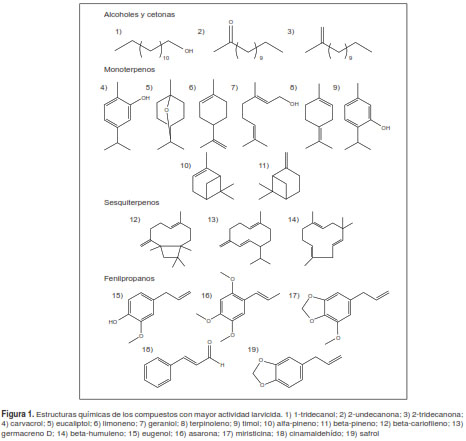
Algunos de los compuestos con mayor actividad larvicida son la 2-undecanona y el 1-tridecanol, con una CL50 de 2,1 y 9,95 µg/ml, respectivamente (79,37). Liu, et al., reportaron una CL50 de 2,86 µg/ml para la 2-tridecanona (86). Varios fenilpropanoides, como el trans-anetol, el cinamaldehído o el eugenol, han presentado una importante actividad larvicida, en tanto que la alfa-asaronafue el fenilpropanoide con mayor actividad larvicida, con una CL50 de 2,7 y de 2,8 µg/ml contra Cx. pipens y Ae. aegypti, respectivamente (42). El alfa-cariofileno y el betacariofileno, este último con actividad repelente relevante, no han presentado actividad larvicida (41,102), mientras que el óxido de cariofileno sí. Los sesquiterpenos con mayor actividad fueron la lactona de dehidrocostus y la costunolida, con una CL50 de 2,34 y 3,26 µg/ml contra Ae. albopictus (107), y el confertifolin con una CL50 de 3,09 y 4,18 µg/ml contra An. sfttephensi y Cx. quinquefasciatus, respectivamente (76).
Ali, et al., evaluaron la actividad repelente y larvicida de la 2-nonanona y la 2-undecanona para determinar qué componente era el responsable de la actividad del aceite esencial de R. chalepensis (79). Sus resultados demostraron que se requieren concentraciones menores de 2-undecanona para repeler mosquitos y eliminar larvas de Ae. aegypti y An. quadrimaculatus. Estos datos sobre el efecto del aceite esencial en su conjunto y de los componentes mayoritarios por separado, son interesantes. El aceite esencial de R. chalepensis ha registrado una CL50 de 22,2 µg/ml contra larvas de Ae. aegypti, mientras que la de su compuesto mayoritario es de CL50 de 14,37 µg/m, lo cual permitiría concluir que la 2-undecanona es la responsable de la actividad larvicida del aceite esencial; sin embargo, es importante resaltar que el aceite esencial en su conjunto posee menor actividad, por lo que se podría concluir que se produce un efecto antagónico entre todos sus componentes.
Los efectos sinérgicos y antagónicos de los componentes de los aceites esenciales se han demostrado (111) y se han discutido con anterioridad (112,113). Se demostró, por ejemplo, que las combinaciones de linalol y 1,8-cineol tenían efectos sinérgicos en la mortalidad de diversos insectos (114), en tanto que la mezcla de timol y transanetol tenía efectos sinérgicos sobre la actividad larvicida contra Spodoptera litura (115). Estos resultados indican que la actividad larvicida de los aceites esenciales no se asocia únicamente con los compuestos mayoritarios, sino que otras moléculas presentes en menor proporción también contribuyen a su actividad (111-115).
El estudio de los efectos sinérgicos se orienta a encontrar mezclas de compuestos que produzcan mejores efectos con menor concentración. En un amplio estudio, se demostró el efecto sinérgico de más de 20 sustancias en diferentes combinaciones contra larvas de Cx. quinquefasciatus; entre las combinaciones más efectivas se encontraron las de limoneno con trans-anetol y de carvona con carvacrol (116). Por otro lado, en este mismo estudio, se señala que la actividad larvicida del borneol y el alcanfor se potencializa cuando se los mezcla, en tanto que de manera aislada no exhiben una actividad significativa. Liu, et al., también han estudiado los efectos sinérgicos y encontraron que la actividad repelente de la mezcla de aceites de Artemisia princeps y Cinnamomum alcanfora era significativamente mayor que la de cada uno de estos por separado (116).
Es necesario ampliar las investigaciones sobre los mecanismos implicados en las interacciones entre los componentes que mejoran o dificultan la actividad repelente y la larvicida, y resaltar la importancia de estudiar dichas actividades en los componentes puros, pues sus mecanismos de acción ofrecen resultados más claros e, incluso, permiten generar modelos predictivos basados en la relación entre su estructura y su actividad.Relación entre estructura y actividad y entre propiedad y actividad
Existe una amplia documentación sobre estos dos tipos de relación de los fitoquímicos y de su actividad larvicida (117,118). Dichos estudios han contribuido a la búsqueda y el diseño de nuevos compuestos con mayor actividad larvicida, y han aportado información sobre su modo de acción en los insectos. Se ha reportado que los anillos aromáticos y los grupos hidroxilos resultan en un aumento de la actividad, particularmente en presencia de grupos fenólicos (119). Además, los grupos hidroxilos parecen disminuir la actividad, ya que al sustituir un grupo carbonilo con un grupo hidroxilo, el resultado final es la disminución de la actividad larvicida (120).
García, et al., por ejemplo, demostraron que de los monoterpenos pulegol (alcohol monoterpeno) y pulegona (cetona monoterpeno), el primero era menos tóxico contra los adultos de Tribolium castaneum (121), debido a que los grupos hidroxilo aumentan la polaridad de las moléculas, lo cual dificulta su penetración en las cutículas de las larvas (122).
Algunos autores han estudiado la importancia de los grupos cetónicos en la estructura de los terpenoides. Los reportes demuestran que la presencia de un grupo carbonilo exocíclico y el doble enlace conjugado parecen contribuir a la actividad larvicida (69). En general, la sustitución del doble enlace por un grupo epóxido disminuye la actividad (69,123). En otros estudios se ha demostrado la importancia de los dobles enlaces en las estructuras terpénicas. Por ejemplo, el beta-pineno tiene mayor actividad larvicida que el alfa-pineno contra Ae. aegypti, lo cual se ha asociado con el hecho de que el doble enlace del beta-pineno se encuentra fuera del anillo, mientras que el alfa-pineno tiene el doble enlace sobre este (58).
Se ha informado que los aldehídos aislados no son importantes para el efecto larvicida; sin embargo, cuando el aldehído está conjugado con un sistema aromático, esto contribuye positivamente a su actividad (124). Este efecto se observa en la gran potencia larvicida del cinamaldehído, un fenilpropanoide totalmente conjugado (103). De hecho, el número de dobles enlaces conjugados contribuye a aumentar la actividad. Se ha reportado que el p-cimeno, el timol, el carvacrol y el eugenol exhiben mayor actividad que la carvona, los pinenos y los terpinenos (99), lo cual evidencia que la influencia de la densidad electrónica y el carácter plano de estas estructuras tienen un papel importante en su actividad biológica (125).
Se ha evaluado la importancia del grupo éster en la actividad larvicida y se ha encontrado que, al sustituir el grupo hidroxilo por un grupo acetato, la actividad larvicida aumenta significativamente (69).
Además de los estudios sobre la relación de la actividad larvicida y la estructura, se han llevado a cabo otros sobre la relación entre las propiedades fisicoquímicas y moleculares y dicha actividad. Se ha observado que el carácter hidrófilo (hydrofilicity) y la capacidad de polarización (refractivity) molar se encuentran en relación negativa con la toxicidad de las cumarinas contra Cx. pipens y Ae. aegypti (118). Esta relación negativa también se ha informado en los terpenos y terpenoides con actividad larvicida (23). El carácter lipófilo de los aceites y sus componentes también tiene un rol clave. Se ha observado que la lipofilia está muy relacionada con la inhibición y la desactivación enzimática (21). La importancia de la lipofilia de los terpenos y terpenoides se ha confirmado al estudiar la relación entre propiedad y actividad, en los cuales el perfil hidrofóbico se ha relacionado estrechamente con la actividad larvicida (119). Lucía, et al., desarrollaron un modelo con base en la actividad de seis monoterpenos y observaron que, cuando los valores de la presión de vapor y el coeficiente de partición del octanol y el agua (LogP) disminuían, también lo hacía la concentración letal de la actividad larvicida contra Ae. aegypti (105).
Este acentuado efecto de la lipofilia se explica por el hecho de que el principal canal de entrada de los componentes en el organismo es táctil (cutícula externa), y el efecto larvicida se evalúa principalmente mediante la inmersión de larvas en un ambiente acuoso donde se aplica el aceite esencial, de manera que puede plantearse que la partición se produce entre el ambiente hidrófilo (agua) y un entorno lipófilo (epicutícula larval), por lo cual la hidrofobia de la molécula desempeña un papel importante en la intoxicación de la larva (126).
Otros descriptores relacionados con la actividad larvicida son el momento dipolar, el punto de ebullición y la presión de vapor (127). El momento dipolar es un indicador de la lipofilia y la hidrofobia (128) y se lo ha asociado con la actividad repelente (129). Por otra parte, se ha demostrado que los repelentes más eficaces poseen un punto de ebullición y una presión de vapor que les permite tener mayor tiempo de contacto con los mosquitos (127). En un estudio llevado a cabo con sesquiterpenos se encontró que la actividad repelente de estos compuestos se relacionaba principalmente con la presión de vapor y con parámetros electrónicos, así como con la capacidad de polarización de la molécula (POL) y el orbital molecular desocupado de menor energía (Lowest Unoccupied Molecular Orbital, LUMO) (130), de tal manera que, en sus modelos, la actividad repelente aumentó a medida que disminuyó la capacidad de polarización, mientras que los parámetros LUMO mantuvieron una relación directa con la actividad. En la figura 2 se ilustra el mapeo de los orbitales frontera del orbital molecular ocupado de mayor energía (Highest Occupied Molecular Orbital, HOMO) y del LUMO de sesquiterpenos con actividad larvicida.
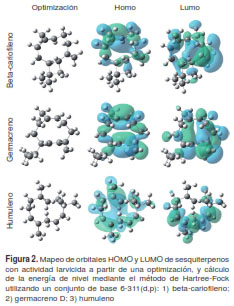
Las energías del orbital molecular ocupado de mayor energía y del orbital desocupado de menor energía (EHOMO y EHOMO ) forman parte de los descriptores mecánico-cuánticos más populares. De hecho, en muchos casos estos orbitales determinan la reacción química de un compuesto y el posible mecanismo de ella (125). El orbital HOMO se emplea como un indicador de las zonas de alta densidad electrónica, pues estas exhiben una región propicia para el ataque de compuestos electrófilos, mientras que un reactivo o compuesto nucleófilo es atraído hacia las zonas de más baja densidad electrónica indicadas por el orbital LUMO (125).
Mecanismo de acción
Muchos grupos de investigación se han centrado en la eficiencia larvicida de los aceites esenciales, sin embargo, hay poca información concluyente sobre su mecanismo de acción contra las larvas y los insectos adultos. La primera complicación se debe a que es difícil determinar los mecanismos de acción de un producto que no es una sustancia pura, sino una mezcla de varios componentes, ya que todas las interacciones entre los compuestos pueden influir en la actividad (131).
En algunos reportes se ha señalado que los aceites esenciales o sus componentes monoterpenoides producen intoxicación neurotóxica, similar a la producida por los organofosforados y carbamatos, mediante la inhibición de la enzima acetilcolinesterasa (132,133). El efecto neurotóxico se produce cuando, en la transmisión del impulso nervioso, la acetilcolina es liberada de las vesículas de las terminales nerviosas cuando estas son despolarizadas y, a continuación, la acetilcolina ingresa a la sinapsis y se une al receptor postsináptico. Esta posee una vida media corta debido a la presencia de la acetilcolinesterasa, una enzima que hidroliza la unión éster de la molécula, con lo cual se interrumpe la actividad estimuladora. La inhibición de la acetilcolinesterasa prolonga la transmisión eléctrica, ya que la acetilcolina está estimulada (134).
En un estudio comparativo de la acción fumígena de los aceites esenciales obtenidos de plantas de la familia Labiatae y el limoneno en adultos de Rhyzopertha dominica,sedemostró que los aceites esenciales en conjunto inhibían en 65 % la acetilcolinesterasa, en tanto que el limoneno lo hacía solamente en el 2 % (117). Además, los autores observaron que los aceites esenciales incrementaron significativamente los niveles de adenosín monofosfato cíclico (incluso con muy bajas concentraciones), lo cual sugiere una posible acción sobre la octopamina.
Se ha reportado también que el aceite esencial de Artemisia maderaspatana inhibe la acetilcolinesterasa con una concentración inhibitoria media (CI50 ) de 31,33 µg/ml (135). Enan, et al., obtuvieron resultados similares en moscas y cucarachas expuestas a eugenol y alfa-terpineol y demostraron que estos compuestos producían efectos de excitación extrema en los insectos, ocasionando posteriormente la muerte (136).
También, se ha demostrado que el limoneno, el mirceno, el linalol y el terpineol son agentes neurotóxicos contra la mosca común (137), resultados que confirman la hipótesis de que el linalol es un fuerte inhibidor de la acetilcolinesterasa (138). De hecho, en estudios de simulación computacional se ha demostrado que el linalol es capaz de interactuar con dicha enzima en Ae. aegypti, lo cual demuestra que este se une a un sitio hidrofóbico interactuando con algunos aminoácidos lipófilos, como la glicina 412, 409, 412 y la isoleucina 413 (139).
Por otro lado, se ha reportado que el aceite esencial de Zingiber officinale altera el comportamiento del sistema colinérgico (140). Asimismo, se ha demostrado que el alfa-pineno y el beta-pineno son capaces de inhibir la acetilcolinesterasa, sin embargo, a pesar de que los pinenos inhiben fuertemente la enzima, no presentan actividad larvicida relevante (141,142), efecto que se ha atribuido a que los pinenos no logran penetrar la cutícula del insecto (143). Otros autores han demostrado que el beta-felandreno es un potente inhibidor de la acetilcolinestersa, al igual que el ocimeno cis y el estragol (144).
En otros estudios de acoplamiento molecular, se ha reportado que el eucaliptol y el carvacrol son capaces de unirse con mayor eficacia que la acetilcolina a la acetilcolinesterasa de Ae. aegypti (145). Asimismo, en estudios de simulación computacional se ha demostrado que el beta-cariofileno tiene mejor energía libre de enlace que la acetilcolinesterasa, por lo cual también constituye un inhibidor competitivo (146). Sin embargo, algunos autores concuerdan en que, en la mayoría de los casos, no hay relación entre la inhibición de la acetilcolinesterasa y los compuestos que demuestran tener mayor efecto larvicida, por lo cual han sugerido que el mecanismo de acción debe ser otro (144,145).
La octopamina también ha sido un blanco de los estudios sobre la actividad de los aceites esenciales. Está presente en el sistema nervioso de todos los insectos y actúa como neurotransmisor, neurohormona y neuromodulador (147). Otra función que se le atribuye está relacionada con el comportamiento activo o de “atención”, por lo que se ha sugerido que forma parte de un sistema general que prepara al insecto para su actividad vigorosa. Algunos autores han planteado que los componentes de los aceites esenciales actúan bloqueando los receptores de la octopamina (131) y produciendo alteraciones neurológicas graves con efectos nocivos para los insectos. El eugenol y el timol, por ejemplo, pueden funcionar mediante el bloqueo de estos receptores (147,148). Con el acoplamiento molecular se ha demostrado que el carvacrol, el eugenol y el eucaliptol son capaces de interactuar en el sitio de unión del receptor oamb de la octopamina de Ae. aegypti (145).
Otro mecanismo propuesto es la interacción de los componentes de los aceites esenciales con los receptores GABA. Se ha demostrado que el timol, por ejemplo, interactúa con estos receptores en un sitio de unión aun no identificado (148,149). Algunos sesquiterpenos tricíclicos han resultado ser potentes inhibidores de estos receptores (150). Asimismo, la tujona, un monoterpenoide bicíclico, se ha clasificado como un insecticida neurotóxico que también actúa sobre estos receptores (151).
Recientemente, se reportó que los terpenos y los terpenoides son capaces de interactuar con la proteína transportadora de esterol (AeSCP-2) de Ae. aegypti, por lo que supone un nuevo y potencial blanco terapéutico (152).
La información que se ha reseñado permite concluir que los componentes de los aceites esenciales no tendrían un solo mecanismo de acción. Además, todo indica que ejercen diversos efectos en el insecto, una vez que atraviesan su cutícula.
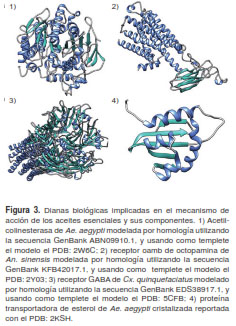
Con respecto a la dilucidación del mecanismo de acción, son pocos los estudios de simulación computacional. Actualmente, la mayoría de los blancos propuestos para el control de Ae. aegypti, se encuentra en forma cristalizada, registrada en bases de datos como la del Proteín Data Bank (PDB) (145,148,152). En el caso de otros géneros y especies, las secuencias aminoacídicas de estas proteínas se encuentran en bases de datos como las del National Center for Biotechnology Information (NCBI). Esta información es de gran utilidad, ya que mediante herramientas computacionales como el acoplamiento y la dinámica molecular se puede llevar a cabo la búsqueda racional de posibles blancos biológicos y la dilucidación de sus mecanismos de acción, así como el diseño de nuevos compuestos larvicidas. La figura 3 ilustra las propuestas de blancos terapeúticos de los componentes de aceites esenciales, algunas de ellas contruídas por homología en nuestro grupo de investigación.
Conclusiones
En la búsqueda de alternativas reales que puedan aplicarse en los programas de control de enfermedades transmitidas por vectores, los aceites esenciales constituyen una excelente alternativa por su considerable potencial como repelentes y larvicidas, su bajo nivel de toxicidad para los mamíferos y su limitado impacto ambiental. Además, algunos, como el metileugenol, la alfa-asarona y la pelitorina, han demostrado ser eficaces contra Cx. p. pallens resistente a clorpirifos, fenitrotión, fentión y alfa-cipermetrina.
La actividad repelente y larvicida de los aceites esenciales es de gran importancia porque demuestra que no es necesario producir un compuesto activo puro, ya que el uso de varios de ellos en conjunto puede ser una solución más barata, eficaz y sencilla. Asimismo, el estudio de los efectos sinérgicos entre los componentes de los aceites esenciales y las mezclas de ellos ha abierto el camino para el reemplazo de los productos sintéticos utilizados tradicionalmente.
El estudio de los componentes puros es crucial para entender el mecanismo de la acción que ejercen sobre las larvas y los moquitos adultos. Por otra parte, las nuevas herramientas computacionales todavía no se han explorado suficientemente, por lo que representan un área de estudio prometedora para la dilucidación de los mecanismos de acción, y el diseño y la búsqueda racional de moléculas con actividad larvicida.
La mayoría de las investigaciones sobre aceites esenciales como nuevos agentes larvicidas se ha llevado a cabo en laboratorio, pero si se los quiere proponer como una solución real y utilizarlos en los programas de salud pública, se requiere la investigación en campo, de manera que las condiciones geográficas y climáticas sean las que determinen la factibilidad y pertinencia de su uso.
Los autores del presente trabajo declaramos no tener conocimiento de ninguna circunstancia que constituya un conflicto de interés, ya sea afectivo, potencial o aparente.
Sergio Andrade-Ochoa agredece el apoyo otorgado por CONACYT (N 3) 4) o de registro 278488) para realizar sus estudios de posgrado, así como al Instituto Chihuahuense de la Juventud. Luvia E. SánchezTorres agradece el apoyo del proyecto SIP-201 50638 y es becaria de la Comisión de Operación y Fomento de Actividades Académicas del Instituto Politécnico Nacional y del Programa de Estímulos al Desempeño de los Investigadores (EDI).
Correspondencia:
Sergio Andrade-Ochoa, Escuela Nacional de Ciencias Biológicas, Instituto Politécnico Nacional, Prolongación de Carpio y Plan de Ayala S/N, Colonia Santo Tomás 11340, Ciudad de México, México
Teléfono: (52) (614) 182 1518
1. Kumar K, Sharma AK, Kumar S, Patel S, Sarkar M, Chauhan LS. Multiple insecticide resistance/susceptibility status of Culex quinquefasciatus, principal vector of bancroftian filariasis from filaria endemic areas of northern India. Asian Pac J Trop Dis. 2011;4:426-9. https://doi.org/10.1016/S1995-7645(11)60119-3
2. Tatem AJ, Huang Z, Das A, Qi Q, Roth J, Qiu Y. Air travel and vector-borne disease movement. Parasitol. 2012;139:181630. https://doi.org/10.1017/S0031182012000352
3. Ramaiah KD, Ottesen EA. Progress and impact of 13 years of the Global Programme to Eliminate Lymphatic Filariasis on reducing the burden of filarial disease. PLoS Negl Trop Dis. 2014;8:e3319. https://doi.org/10.1371/journal.pntd.0003319
4. Campbell LP, Luther C, Moo-Llanes D, Ramsey JM, Danis Lozano R, Peterson AT. Climate change influences on global distributions of dengue and chikungunya virus vectors. Philos Trans R Soc Lond B Biol Sci. 2015;370:20140135. https://doi.org/10.1098/rstb.2014.0135
5. Bhatia R, Dash AP, Sunyoto T. Changing epidemiology of dengue in South-East Asia. WHO South East Asia J Public Health. 2013;2:23. https://doi.org/10.4103/2224-3151.115830
6. Tolle MA. Mosquito-borne diseases. Curr Probl Pediatr Adolesc Health Care. 2009;39:97-140. https://doi.org/10.1016/j.cppeds.2009.01.001
7. Fischer D, Thomas SM, Suk JE, Sudre B, Hess A, Tjaden NB, et al. Climate change effects on Chikungunya transmission in Europe: Geospatial analysis of vector’s climatic suitability and virus’ temperature requirements. Int J Health Geogr. 2013;12:51. https://doi.org/10.1186/1476072X-12-51
8. van Bortel W, Dorleans F, Rosine J, Blateau A, Rousset D, Matheus S, et al. Chikungunya outbreak in the Caribbean region, December 2013 to March 2014, and the significance for Europe. Euro Surveill. 2014;19:20759.
9. World Health Organization. World Malaria Report 2015. Geneva: WHO; 2015. Fecha de consulta: 15 de junio de 2015. Disponible en: http://www.who.int/malaria/publications/world-malaria-report-2015/report/en/.
10. Béguin A, Hales S, Rocklöv J, Åström C, Louis VR, Sauerborn R. The opposing effects of climate change and socio-economic development on the global distribution of malaria. Glob Environ Chang.2011;21:1209-14. https://doi.org/10.1016/j.gloenvcha.2011.06.001
11. Laniak GF, Olchin G, Goodall J, Voinov A, Hill M, Glynn P, et al. Integrated environmental modeling: A vision and roadmap for the future. Environ Model Softw. 2013;39:3-23. https://doi.org/10.1016/j.envsoft.2012.09.006
12. Shuman EK. Global climate change and infectious diseases. New Eng J Med. 2010;362:1061-3. https://doi.org/10.1056/NEJMp0912931
13. Ocampo CB, Salazar-Terreros MJ, Mina NJ, McAllister J, Brogdon W. Insecticide resistance status of Aedes aegypti in 10 localities in Colombia. Acta Trop. 2011;118:37-44. https://doi.org/10.1016/j.actatropica.2011.01.007
14. Miranda JE, Navickiene HM, Nogueira-Couto RH, De Bortoli SA, Kato MJ, da Silva Bolzani V, et al. Susceptibility of Apis mellifera (Hymenoptera: Apidae) to pellitorine, an amide isolated from Piper tuberculatum (Piperaceae). Apidologie. 2003;34:409-15. https://doi.org/10.1051/apido:2003036
15. Lin H, Chuan-hua X, Jin-jun W, Ming L, Wen-cai L, Zhimo Z. Resistance selection and biochemical mechanism of resistance to two acaricides in Tetranychus cinnabarinus (Boiduval). Pest Biochem Physiol. 2009;93:47-52. https://doi.org/10.1016/j.pestbp.2008.11.001
16. Matowo J, Kitau J, Kabula B, Kavishe R, Oxborough R, Kaaya R, et al. Dynamics of insecticide resistance and the frequency of kdr mutation in the primary malaria vector Anopheles arabiensis in rural villages of Lower Moshi, North Eastern Tanzania. J Parasitol Vector Biol. 2014;6:31-41. https://doi.org/10.5897/JPVB2013.0143
17. Vontas J, Kioulos E, Pavlidi N, Morou E, Della Torre A, Ranson H. Insecticide resistance in the major dengue vectors Aedes albopictus and Aedes aegypti. Pest Biochem Physiol. 2012;104:126-31. https://doi.org/10.1016/j.pestbp.2012.05.008
18. Chino-Cantor A, Sánchez-Arroyo H, Ortega-Arenas LD, Castro-Hernández E. Insecticide susceptibility of Aedes aegypti L. (Diptera: Culicidae) in Guerrero, México. Southwestern Entomol. 2014;39:601-12. https://doi.org/10.3958/059.039.0319
19. Overgaard HJ, Sandve SR, Suwonkerd W. Evidence of anopheline mosquito resistance to agrochemicals in northern Thailand. Southeast Asian J Trop Med Public Health.2005;36(Suppl.4):152-7.
20. Conde M, Orjuela LI, Castellanos CA, Herrera-Varela M, Licastro S, Quiñones ML. Insecticide susceptibility evaluation in Aedes aegypti populations of Caldas, Colombia, in 2007 and 2011. Biomédica. 2015;35:43-52. https://doi.org/10.7705/biomedica.v35i1.2367
21. Langenheim JH. Higher plant terpenoids: A phytocentric overview of their ecological roles. J Chem Ecol. 1994;20:1223-80. https://doi.org/10.1007/BF02059809
22. Wang ZQ, Perumalsamy H, Wang M, Shu S, Ahn YJ. Larvicidal activity of Magnolia denudata seed hydrodistillate constituents and related compounds and liquid formulations towards two susceptible and two wild mosquito species. Pest Manag Sci. 2015;72:897-906. https://doi.org/10.1002/ps.4064
23. Massebo F, Tadesse M, Bekele T, Gebre-Michael MB. Evaluation on larvicidal effects of essential oils of some local plants against Anopheles arabiensis Patton and Aedes aegypti Linnaeus (Diptera, Culicidae) in Ethiopia. Afr J Biotechnol. 2009;8:4183.
24. Castillo S, Pérez-Alfonso CO, Martínez-Romero D, Guillén F, Serrano M, Valero D. The essential oils timol and carvacrol applied in the packing lines avoid lemon spoilage and maintain quality during storage. Food Control. 2014;35:132-6. https://doi.org/10.1016/j.foodcont.2013.06.052
25. Bakkali F, Averbeck S. Averbeck D, Idaomar M. Biological effects of essential oils–a review. Food Chem Toxicol. 2008;46:446-75. https://doi.org/10.1016/j.fct.2007.09.106
26. Burt S. Essential oils: Their antibacterial properties and potential applications in foods–a review. Int J Food Microbiol. 2004;94:223-53. https://doi.org/10.1016/j.ijfoodmicro.2004.03.022
27. Pesavento G, Calonico C, Bilia AR, Barnabei M, Calesini F, Addona R, et al. Antibacterial activity of Oregano, Rosmarinus and Thymus essential oils against Staphylococcus aureus and Listeria monocytogenes in beef meatballs. Food Control. 2015;54:188-99. https://doi.org/10.1016/j.foodcont.2015.01.045
28. Sarac N, Ugur A. Antimicrobial activities of the essential oils of Origanum onites L., Origanum vulgare L. subspecies hirtum (Link) Ietswaart, Satureja thymbra L., and Thymus cilicicus Boiss. & Bal. growing wild in Turkey. J Med Food. 2008;11:568-73. https://doi.org/10.1089/jmf.2007.0520
29. Santoro GF, das Graças Cardoso M, Guimarães LG, Salgado AP, Menna-Barreto RF, Soares MJ. Effect of oregano (Origanum vulgare L.) and thyme (Thymus vulgaris L.) essential oils on Trypanosoma cruzi (Protozoa: Kinetoplastida) growth and ultrastructure. Parasitol Res. 2007;100:783-90. https://doi.org/10.1007/s00436-006-0326-5
30. Prophiro JS, da Silva MA, Kanis LA, da Silva BM, Duque-Luna JE, da Silva OS. Evaluation of time toxicity, residual effect, and growth-inhibiting property of Carapa guianensis and Copaifera sp. in Aedes aegypti. Parasitol Res. 2012;110:713-9. https://doi.org/10.1007/s00436-0112547-5
31. Batish DR, Singh HP, Kohli RK, Kaur S. Eucalyptus essential oil as a natural pesticide. Forest Ecol Manag. 2008;256:2166-74. https://doi.org/10.1016/j.foreco.2008.08.008
32. Kiran SR, Bhavani K, Devi PS, Rao BR, Reddy KJ. Composition and larvicidal activity of leaves and stem essential oils of Chloroxylon swietenia DC against Aedes aegypti and Anopheles stephensi. Bioresour Technol. 2006;97:2481-4. https://doi.org/10.1016/j.biortech.2005.10.003
33. World Health Organization. Guidelines for laboratory and field testing of mosquito larvicides. Geneva: WHO; 2005. Fecha de consulta: 15 de junio de 2015. Disponible en:http://www.who.int/whopes/guidelines/en/.
34. Benelli G, Bedini S, Flamini G, Cosci F, Cioni PL, Amira S, et al. Mediterranean essential oils as effective weapons against the West Nile vector Culex pipiens and the Echinostoma intermediate host Physella acuta: What happens around? An acute toxicity survey on non-target mayflies. Parasitol Res. 2015;114:1011-21. https://doi.org/10.1007/s00436-014-4267-0
24. Castillo S, Pérez-Alfonso CO, Martínez-Romero D, Guillén F, Serrano M, Valero D. The essential oils timol and carvacrol applied in the packing lines avoid lemon spoilage and maintain quality during storage. Food Control. 2014;35:132-6. https://doi.org/10.1016/j.foodcont.2013.06.052
25. Bakkali F, Averbeck S. Averbeck D, Idaomar M. Biological effects of essential oils–a review. Food Chem Toxicol. 2008;46:446-75. https://doi.org/10.1016/j.fct.2007.09.106
26. Burt S. Essential oils: Their antibacterial properties and potential applications in foods–a review. Int J Food Microbiol. 2004;94:223-53. https://doi.org/10.1016/j.ijfoodmicro.2004.03.022
27. Pesavento G, Calonico C, Bilia AR, Barnabei M, Calesini F, Addona R, et al. Antibacterial activity of Oregano, Rosmarinus and Thymus essential oils against Staphylococcus aureus and Listeria monocytogenes in beef meatballs. Food Control. 2015;54:188-99. https://doi.org/10.1016/j.foodcont.2015.01.045
28. Sarac N, Ugur A. Antimicrobial activities of the essential oils of Origanum onites L., Origanum vulgare L. subspecies hirtum (Link) Ietswaart, Satureja thymbra L., and Thymus cilicicus Boiss. & Bal. growing wild in Turkey. J Med Food. 2008;11:568-73. https://doi.org/10.1089/jmf.2007.0520
29. Santoro GF, das Graças Cardoso M, Guimarães LG, Salgado AP, Menna-Barreto RF, Soares MJ. Effect of oregano (Origanum vulgare L.) and thyme (Thymus vulgaris L.) essential oils on Trypanosoma cruzi (Protozoa: Kinetoplastida) growth and ultrastructure. Parasitol Res. 2007;100:783-90. https://doi.org/10.1007/s00436-006-0326-5
30. Prophiro JS, da Silva MA, Kanis LA, da Silva BM, Duque-Luna JE, da Silva OS. Evaluation of time toxicity, residual effect, and growth-inhibiting property of Carapa guianensis and Copaifera sp. in Aedes aegypti. Parasitol Res. 2012;110:713-9. https://doi.org/10.1007/s00436-0112547-5
31. Batish DR, Singh HP, Kohli RK, Kaur S. Eucalyptus essential oil as a natural pesticide. Forest Ecol Manag. 2008;256: 2166-74. https://doi.org/10.1016/j.foreco.2008.08.008
32. Kiran SR, Bhavani K, Devi PS, Rao BR, Reddy KJ. Composition and larvicidal activity of leaves and stem essential oils of Chloroxylon swietenia DC against Aedes aegypti and Anopheles stephensi. Bioresour Technol. 2006;97: 2481-4. https://doi.org/10.1016/j.biortech.2005.10.003
33. World Health Organization. Guidelines for laboratory and field testing of mosquito larvicides. Geneva: WHO; 2005. Fecha de consulta: 15 de junio de 2015. Disponible en: http://www.who.int/whopes/guidelines/en/.
34. Benelli G, Bedini S, Flamini G, Cosci F, Cioni PL, Amira S, et al. Mediterranean essential oils as effective weapons against the West Nile vector Culex pipiens and the Echinostoma intermediate host Physella acuta: What happens around? An acute toxicity survey on non-target mayflies. Parasitol Res. 2015;114:1011-21. https://doi.org/10.1007/s00436-014-4267-0
35. Liu XC, Liu QY, Zhou L, Liu ZL. Evaluation of larvicidal activity of the essential oil of Allium macrostemon Bunge and its selected major constituent compounds against Aedes albopictus (Diptera: Culicidae). Parasit Vector. 2014;7:184. https://doi.org/10.1186/1756-3305-7-184
36. Moon HI. Larvicidal activity of major essential oils from stems of Allium monanthum Maxim. against Aedes aegypti L. J Enzyme Inhib Med Chem. 2011;26:827-30. https://doi.org/10.3109/14756366.2011.558842
37. Tabanca N, Gao Z, Demirci B, Techen N, Wedge DE, Ali A, et al. Molecular and phytochemical investigation of Angelica dahurica and Angelica pubescentis essential oils and their biological activity against Aedes aegypti, Stephanitis pyrioides, and Colletotrichum Species. J Agric Food Chem. 2014;62:8848-57. https://doi.org/10.1021/jf5024752
38. Santos GK, Dutra KA, Barros RA, da Câmara CA, Lira DD, Gusmão NB, et al. Essential oils from Alpinia purpurata (Zingiberaceae): Chemical composition, oviposition deterrence, larvicidal and antibacterial activity. Ind Crop Prod. 2012;40:254-60. https://doi.org/10.1016/j.indcrop.2012.03.020
39. Pitasawat B, Champakaew D, Choochote W, Jitpakdi A, Chaithong U, Kanjanapothi D, et al. Aromatic plant-derived essential oil: An alternative larvicide for mosquito control. Fitoterapia. 2007;78:205-10. https://doi.org/10.1016/j.fitote.2007.01.003
40. Cheah SX, Tay JW, Chan LK, Jaal Z. Larvicidal, oviposition, and ovicidal effects of Artemisia annua (Asterales:Asteraceae) against Aedes aegypti, Anopheles sinensis, and Culex quinquefasciatus (Diptera: Culicidae). Parasitol Res. 2013;112:3275-82. https://doi.org/10.1007/s00436-013-3506-0
41. Zhu L, Tian Y. Chemical composition and larvicidal activity of essential oil of Artemisia gilvescens against Anopheles anthropophagus. Parasitol Res. 2013;112:1137-42. https://doi.org/10.1007/s00436-012-3243-9
42. Perumalsamy H, Chang KS, Park C, Ahn YJ. Larvicidal activity of Asarum heterotropoides root constituents against insecticide-susceptible and-resistant Culex pipiens pallens and Aedes aegypti and Ochlerotatus togoi. J Agric Food Chem. 2010:58:10001-6. https://doi.org/10.1021/jf102193k
43. Arun KD, Kumar S, Swamy JP. Larvicidal activity and leaf essential oil composition of three species of genus Atalantia from south India. Int J Mos Res. 2015;2:25-9.
44. Zhu L, Tian Y. Chemical composition and larvicidal activity of Blumea densiflora essential oils against Anopheles anthropophagus: A malarial vector mosquito. Parasitol Res. 2011;109:1417-22. https://doi.org/10.1007/s00436-011-2388-2
45. Senthilkumar A, Kannathasan K, Venkatesalu V. Chemical constituents and larvicidal property of the essential oil of Blumea mollis (D. Don) Merr. against Culex quinquefasciatus. Parasitol Res. 2008;103:959-62. https://doi.org/10.1007/s00436-008-1085-2
46. Tan LTH, Lee LH, Yin WF, Chan CK, Abdul Kadir H, Chan KG, et al. Traditional uses, phytochemistry, and bioactivities of Cananga odorata (Ylang-Ylang). Evid Based Complement Alternat Med. 2015;2015:896314. https://doi.org/10.1155/2015/896314
47. Souza LG, Almeida MC, Monte FJ, Santiago GM, Braz-Filho R, Lemos TL, et al. Chemical constituents of Capraria biflora (Scrophulariaceae) and larvicidal activity of essential oil. Química Nova. 2012;35:2258-62. https://doi.org/10.1590/S0100-40422012001100032
48. Cheng SS, Liu JY, Huang CG, Hsui YR, Chen WJ, Chang ST. Insecticidal activities of leaf essential oils from Cinnamomum osmophloeum against three mosquito species. Bioresource Technol. 2009;100:457-64. https://doi.org/10.1016/j.biortech.2008.02.030
49. Akono PN, Dongmo PM, Tonga C, Kouotou S, Kekeunou S, Magne GT, et al. Larvicidal activity of essential oils from pericarps of ripe Citrus fruits cultivated in Cameroon on pyrethroids sensitive and resistant strains of Anopheles gambiae Giles, 1902. J Entomol Zool Studies. 2015;3:334-9.
50. Giatropoulos A, Papachristos DP, Kimbaris A, Koliopoulos G, Polissiou MG, Emmanouel N, et al. Evaluation of bioefficacy of three Citrus essential oils against the dengue vector Aedes albopictus (Diptera: Culicidae) in correlation to their components enantiomeric distribution. Parasitol Res. 2012;111:2253-63. https://doi.org/10.1007/s00436-012-3074-8
51. Tennyson S, Samraj DA, Jeyasundar D, Chalieu K. Larvicidal efficacy of plant oils against the dengue vector Aedes aegypti (L.) (Diptera: Culicidae). Middle-East Journal of Scientific Research. 2013;13:64-8. https://doi.org/10.5829/idosi.mejsr.2013.13.1.64107
52. Vera SS, Zambrano DF, Méndez-Sánchez SC, RodríguezSanabria F, Stashenko EE, Luna JE. Essential oils with insecticidal activity against larvae of Aedes aegypti (Diptera: Culicidae). Parasitol Res. 2014;113:2647-54. https://doi.org/10.1007/s00436-014-3917-6
53. Govindarajan M. Chemical composition and larvicidal activity of leaf essential oil from Clausena anisata (Willd.) Hook. f. ex Benth (Rutaceae) against three mosquito species. Asian Pac J Trop Med. 2010;3:874-7. https://doi.org/10.1016/S1995-7645(10)60210-6
54. Govindarajan M, Sivakumar R, Rajeswary M, Veerakumar K. Mosquito larvicidal activity of timol from essential oil of Coleus aromaticus Benth. against Culex tritaeniorhynchus, Aedes albopictus, and Anopheles subpictus (Diptera: Culicidae). Parasitol Res. 2013;112:3713-21. https://doi.org/10.1007/s00436-013-3557-2
55. Ali A, Wang YH, Khan IA. Larvicidal and biting deterrent activity of essential oils of Curcuma longa, ar-turmerone, and curcuminoids against Aedes aegypti and Anopheles quadrimaculatus (Culicidae: Diptera). J Med Entomol. 2015;52:979-86. https://doi.org/10.1093/jme/tjv072
56. Giatropoulos A, Pitarokili D, Papaioannou F, Papachristos DP, Koliopoulos G, Emmanouel N, et al. Essential oil composition, adult repellency and larvicidal activity of eight Cupressaceae species from Greece against Aedes albopictus (Diptera: Culicidae). Parasitol Res. 2013;112:1113-1123. https://doi.org/10.1007/s00436-012-3239-5
57. Cheng SS, Huang CG, Chen YJ, Yu JJ, Chen WJ, Chang ST. Chemical compositions and larvicidal activities of leaf essential oils from two eucalyptus species. Bioresour Technol. 2009;100:452-6. https://doi.org/10.1016/j.biortech.2008.02.038
58. Lucía A, González-Audino P, Seccacini, E, Licastro S, Zerba E, Masuh H. Larvicidal effect of Eucalyptus grandis essential oil and turpentine and their major components on Aedes aegypti larvae. J Am Mosq Control Assoc. 2007;23:299-303. https://doi.org/10.2987/8756-971X(2007)23[299:LEOEGE]2.0.CO;2
59. Lucía A, Licastro S, Zerba E, Masuh H. Yield, chemical composition, and bioactivity of essential oils from 12 species of Eucalyptus on Aedes aegypti larvae. Entomol Exp Appl. 2008;129:107-14. https://doi.org/10.1111/j.15707458.2008.00757.x
60. Intirach J, Junkum A, Tuetun B, Choochote W, Chaithong U, Jitpakdi A, et al. Chemical constituents and combined larvicidal effects of selected essential oils against Anopheles cracens (Diptera: Culicidae). Psyche. 2012;2012:1-11. https://doi.org/10.1155/2012/591616
61. Rocha DK, Matosc O, Novoa MT, Figueiredo AC, Delgado M, Moiteiro C. Larvicidal activity against Aedes aegypti of Foeniculum vulgare essential oils from Portugal and Cape Verde. Nat Prod Commun. 2015;10:677-82.
62. Aciole SD, Piccoli CF, Costa EV, Navarro-Silva MA, Márques FA, Sales-Maia BH, et al. Insecticidal activity of three species of Guatteria (Annonaceae) against Aedes aegypti (Diptera: Culicidae). Revista Colombiana de Entomología. 2011;37:262-8.
63. Liu XC, Liu QY, Zhou L, Liu ZL. Larvicidal activity of essential oil derived from Illicium henryi Diels (Illiciaceae) Leaf. Trop J Pharm Res. 2015;14:111-6. https://doi.org/10.4314/tjpr.v14i1.16
64. Tabanca N, Avonto C, Wang M, Parcher JF, Ali A, Demirci B, et al. Comparative investigation of Umbellularia californica and Laurus nobilis leaf essential oils and identification of constituents active against Aedes aegypti. J Agric Food Chem. 2013;61:12283-91. https://doi.org/10.1021/jf4052682
65. Silva WJ, Dória GA, Maia RT, Nunes RS, Carvalho GA, Blank AF, et al. Effects of essential oils on Aedes aegypti larvae: Alternatives to environmentally safe insecticides. Bioresource Technol. 2008;99:3251-5. https://doi.org/10.1016/j.biortech.2007.05.064
66. Gleiser RM, Zygadlo JA. Insecticidal properties of essential oils from Lippia turbinata and Lippia polystachya (Verbenaceae) against Culex quinquefasciatus (Diptera: Culicidae). Parasitol Res. 2007;101:1349-54. https://doi.org/10.1007/s00436-007-0647-z
67. Lima GP, de Souza TM, de Paula Freire G, Farias DF, Cunha AP, Ricardo NM, et al. Further insecticidal activities of essential oils from Lippia sidoides and Croton species against Aedes aegypti L. Parasitol Res. 2013;112:1953-8. https://doi.org/10.1007/s00436-013-3351-1
68. Koliopoulos G, Pitarokili D, Kioulos E, Michaelakis A, Tzakou O. Chemical composition and larvicidal evaluation of Mentha, Salvia, and Melissa essential oils against the West Nile virus mosquito Culex pipiens. Parasitol Res. 2010;107:327-35. https://doi.org/10.1007/s00436-010-1865-3
69. Lima TC, da Silva TK, Silva FL, Barbosa-Filho JM, Marques MO, Santos RL, et al. Larvicidal activity of Mentha x villosa Hudson essential oil, rotundifolone and derivatives. Chemosphere. 2014;104:37-43. https://doi.org/10.1016/j.chemosphere.2013.10.035
70. Raj GA, Chandrasekaran M, Krishnamoorthy S, Jayaraman M, Venkatesalu V. Phytochemical profile and larvicidal properties of seed essential oil from Nigella sativa L. (Ranunculaceae), against Aedes aegypti, Anopheles stephensi, and Culex quinquefasciatus (Diptera: Culicidae). Parasitol Res. 2015;114:3385-91. https://doi.org/10.1007/s00436-015-4563-3
71. Govindarajan M, Sivakumar R, Rajeswary M, Yogalakshmi K. Chemical composition and larvicidal activity of essential oil from Ocimum basilicum (L.) against Culex tritaeniorhynchus, Aedes albopictus and Anopheles subpictus (Diptera: Culicidae). Exp Parasitol. 2013;134:7-11. https://doi.org/10.1016/j.exppara.2013.01.018
72. Kulkarni RR, Pawar PV, Joseph MP, Akulwad AK, Sen A, Joshi SP. Lavandula gibsoni and Plectranthus mollis essential oils: Chemical analysis and insect control activities against Aedes aegypti, Anopheles sfttephensi and Culex quinquefasciatus. J Pest Sci. 2013;86:713-8. https://doi.org/10.1007/s10340-013-0502-1
73. Pavela R. Insecticidal properties of Pimpinella anisum essential oils against the Culex quinquefasciatus and the non-target organism Daphnia magna. J Asia-Pacific Entomol. 2014;17:287-93. https://doi.org/10.1016/j.aspen.2014.02.001
74. Koutsaviti K, Giatropoulos A, Pitarokili D, Papachristos D, Michaelakis A, Tzakou O. Greek Pinus essential oils: Larvicidal activity and repellency against Aedes albopictus (Diptera: Culicidae). Parasitol Res. 2015;114:583-92. https://doi.org/10.1007/s00436-014-4220-2
75. Gokulakrishnan J, Kuppusamy E, Shanmugam D, Appavu A, Kaliyamoorthi K. Pupicidal and repellent activities of Pogostemon cablin essential oil chemical compounds against medically important human vector mosquitoes. Asian Pac J Trop Dis. 2013;3:26-31. https://doi.org/10.1016/S2222-1808(13)60006-7
76. Maheswaran R, Ignacimuthu S. Bioefficacy of essential oil from Polygonum hydropiper L. against mosquitoes, Anopheles stephensi and Culex quinquefasciatus. Ecotoxicol Environ Saf. 2013;97:26-31. https://doi.org/10.1016/j.ecoenv.2013.06.028
77. Conti B, Leonardi M, Pistelli L, Profeti R, Ouerghemmi I, Benelli G. Larvicidal and repellent activity of essential oils from wild and cultivated Ruta chalepensis L.(Rutaceae) against Aedes albopictus Skuse (Diptera: Culicidae), an arbovirus vector. Parasitol Res. 2013;112:991-9. https://doi.org/10.1007/s00436-012-3221-2
78. López LAP, Yael C, Cirio AT. Essential oils from Zanthoxylum fagara Wild Lime, Ruta chalepensis L. and Thymus vulgaris L.: Composition and activity against Aedes aegypti larvae. Pak J Pharm Sci. 2015;28:1911-5.
79. Ali A, Demirci B, Kiyan HT, Bernier UR, Tsikolia M, Wedge DE, et al. Biting deterrence, repellency, and larvicidal activity of Ruta chalepensis (Sapindales: Rutaceae) essential oil and its major individual constituents against mosquitoes. J Med Entomol. 2013;50:1267-74. https://doi.org/10.1603/ME12177
80. Mathew J, Thoppil JE. Chemical composition and mosquito larvicidal activities of Salvia essential oils. Pharm Biol. 2011; 49:456-63. https://doi.org/10.3109/13880209.2010.523427
81. Pavela R. Larvicidal property of essential oils against Culex quinquefasciatus Say (Diptera: Culicidae). Ind Crops Prod. 2009;30:311-5. https://doi.org/10.1016/j.indcrop.2009.06.005
82. Aguiar RW, dos Santos SF, da Silva Morgado F, Ascencio SD, de Mendonça Lopes M, Viana KF, et al. Insecticidal and repellent activity of Siparuna guianensis Aubl.(Negramina) against Aedes aegypti and Culex quinquefasciatus. PloS One. 2015;10:e0116765. https://doi.org/10.1371/journal.pone.0116765
83. Barbosa JD, Silva VB, Alves PB, Gumina G, Santos RL, Sousa DP, et al. Structure–activity relationships of eugenol derivatives against Aedes aegypti (Diptera: Culicidae) larvae. Pest Manag Sci. 2012;68:1478-83. https://doi.org/10.1002/ps.3331
84. Marques MM, Morais SM, Vieira íG, Vieira MG, Silva AR, De Almeida RR, et al. Larvicidal activity of Tagetes erecta against Aedes aegypti. J Am Mosq Control Assoc. 2011;27:156-8. https://doi.org/10.2987/10-6056.1
85. Ruiz C, Cachay M, Domínguez M, Velásquez C, Espinoza G, Ventosilla P, et al. Chemical composition, antioxidant and mosquito larvicidal activities of essential oils from Tagetes filifolia, Tagetes minuta and Tagetes elliptica from Perú. Planta Med. 2011;77:PE30. https://doi.org/10.1055/s0031-1282361
86. Liu XC, Liu Q, Chen XB, Zhou L, Liu ZL. Larvicidal activity of the essential oil from Tetradium glabrifolium fruits and its constituents against Aedes albopictus. Pest Manag Sci. 2015;71:1582-6. https://doi.org/10.1002/ps.3964
87. Trongtokit Y, Rongsriyam Y, Komalamisra N, Apiwathnasorn C. Comparative repellency of 38 essential oils against mosquito bites. Phytother Res. 2005;19:303-9. https://doi.org/10.1002/ptr.1637
88. Gillij YG, Gleiser RM, Zygadlo JA. Mosquito repellent activity of essential oils of aromatic plants growing in Argentina. Bioresour Technol. 2008;99:2507-15. https://doi.org/10.1016/j.biortech.2007.04.066
89. Moore SJ, Hill N, Ruiz C, Cameron MM. Field evaluation of traditionally used plant-based insect repellents and fumigants against the malaria vector Anopheles darlingi in Riberalta, Bolivian Amazon. J Med Entomol. 2007;44:62430. https://doi.org/10.1093/jmedent/44.4.624
90. de Paula JP, Gomes-Carneiro M, Paumgartten FJ. Chemical composition, toxicity and mosquito repellency of Ocimum selloi oil. J Ethnopharmacol. 2003;88:253-60. https://doi.org/10.1016/S0378-8741(03)00233-2
91. Jaenson TG, Pålsson K, Borg-Karlson AK. Evaluation of extracts and oils of mosquito (Diptera: Culicidae) repellent plants from Sweden and Guinea-Bissau. J Med Entomol. 2006;43:113-9. https://doi.org/10.1093/jmedent/43.1.113
92. Phasomkusolsil S, Soonwera M. Comparative mosquito repellency of essential oils against Aedes aegypti (Linn.), Anopheles dirus (Peyton and Harrison) and Culex quinquefasciatus (Say). Asian Pac J Trop Biomed. 2011;1:S113-8. https://doi.org/10.1016/S2221-1691(11)60136-6
93. Amer A, Mehlhorn H. Repellency effect of forty-one essential oils against Aedes, Anopheles, and Culex mosquitoes. Parasitol Res. 2006;99:478-90. https://doi.org/10.1007/s00436-006-0184-1
94. Waliwitiya R, Kennedy CJ, Lowenberger CA. Larvicidal and oviposition-altering activity of monoterpenoids, transanithole and rosemary oil to the yellow fever mosquito Aedes aegypti (Diptera: Culicidae). Pest Manag Sci. 2009; 65:241-8. https://doi.org/10.1002/ps.1675
95. Pavela R. Acute toxicity and synergistic and antagonistic effects of the aromatic compounds of some essential oils against Culex quinquefasciatus Say larvae. Parasitol Res. 2015;114:3835-53. https://doi.org/10.1007/s00436015-4614-9
96. Sousa RMO, Rosa JS, Silva CA, Almeida MTM, Novo MT, Cunha AC, et al. Larvicidal, molluscicidal and nematicidal activities of essential oils and compounds from Foeniculum vulgare. J Pest Sci. 2015;88:413-26. https://doi.org/10.1007/s10340-014-0628-9
97. Pavela R. Essential oils for the development of eco-friendly mosquito larvicides: A review. Ind Crops Prod. 2015;76:174-187. https://doi.org/10.1016/j.indcrop.2015.06.050
98. Rana IS, Rana AS. Efficacy of essential oils of aromatic plants as larvicide for the management of filarial vector Culex quinquefasciatus Say (Diptera: Culicidae) with special reference to Foeniculum vulgare. Asian Pac J Trop Dis. 2012;2:184-9. https://doi.org/10.1016/S22221808(12)60044-9
99. Santos SR, Silva VB, Melo MA, Barbosa JD, Santos RL, de Sousa DP, et al. Toxic effects on and structuretoxicity relationships of phenylpropanoids, terpenes, and related compounds in Aedes aegypti larvae. Vector Borne Zoonotic Dis. 2010;10:1049-54. https://doi.org/10.1089/vbz.2009.0158
100. Gokulakrishnan J, Kuppusamy E, Shanmugam D, Appavu A, Kaliyamoorthi K. Pupicidal and repellent activi-ties of Pogostemon cablin essential oil chemical compounds against medically important human vector mosquitoes. Asian Pac J Trop Dis. 2013;3:26-31. https://doi.org/10.1016/S2222-1808(13)60006-7
101. Ali A, Tabanca N, Ozek G, Ozek T, Aytac Z, Bernier UR, et al. Essential oils of Echinophora lamondiana (apiales: Umbelliferae): A relationship between chemical profile and biting deterrence and larvicidal activity against mosquitoes (Diptera: Culicidae). J Med Entomol. 2015;52:93-100. https://doi.org/10.1093/jme/tju014
102. Dória GA, Silva WJ, Carvalho GA, Alves PB, Cavalcanti SC. A study of the larvicidal activity of two Croton species from northeastern Brazil against Aedes aegypti. Pharm Biol. 2010;48:615-20. https://doi.org/10.3109/13880200903222952
103. Radwan MA, El-Zemity SR, Mohamed SA, Sherby SM. Larvicidal activity of some essential oils, monoterpenoids and their corresponding N-metil carbamate derivatives against Culex pipiens (Diptera: Culicidae). Int J Trop Ins Sci. 2008;28:61-8. https://doi.org/10.1017/S1742758408962366
104. Cheng SS, Chua MT, Chang EH, Huang CG, Chen WJ, Chang ST. Variations in insecticidal activity and chemical compositions of leaf essential oils from Cryptomeria japonica at different ages. Bioresource Technol. 2009;100:465-70. https://doi.org/10.1016/j.biortech.2007.11.060
105. Lucía A, Zerba E, Masuh H. Knockdown and larvicidal activity of six monoterpenes against Aedes aegypti (Diptera: Culicidae) and their structure-activity relationships. Parasitol Res. 2013;112:4267-72. https://doi.org/10.1007/s00436-013-3618-6
106. Perumalsamy H, Kim NJ, Ahn, AJ. Larvicidal activity of compounds isolated from Asarum heterotropoides against Culex pipiens pallens, Aedes aegypti, and Ochlerotatus togoi (Diptera: Culicidae). J Med Entomol. 2009;46:1420-3. https://doi.org/10.1603/033.046.0624
107. Liu ZL, He Q, Chu SS, Wang CF, Du SS, Deng ZW. Essential oil composition and larvicidal activity of Saussurea lappa roots against the mosquito Aedes albopictus (Diptera: Culicidae). Parasitol Res. 2012;110:2125-30. https://doi.org/10.1007/s00436-011-2738-0
108. Kaufman PE, Mann RS, Butler JF. Evaluation of semiochemical toxicity to Aedes aegypti, Ae. albopictus and Anopheles quadrimaculatus (Diptera: Culicidae). Pest Manag Sci. 2010;66:497-504. https://doi.org/10.1002/ps.1899
109. Liu XC, Dong HW, Zhou L, Du SS, Liu ZL. Essential oil composition and larvicidal activity of Toddalia asiatica roots against the mosquito Aedes albopictus (Diptera: Culicidae). Parasitol Res. 2013;112:1197-203. https://doi.org/10.1007/s00436-012-3251-9
110. Ali A, Murphy CC, Demirci B, Wedge DE, Sampson BJ, Khan IA, et al. Insecticidal and biting deterrent activity of rose-scented geranium (Pelargonium spp.) essential oils and individual compounds against Stephanitis pyrioides and Aedes aegypti. Pest Manag Sci. 2013;69:1385-92. https://doi.org/10.1002/ps.3518
111. Lahlou M. Methods to study the phytochemistry and bioactivity of essential oils. Phytotherapy Res. 2004;18:435-48. https://doi.org/10.1002/ptr.1465
112. Shaalan EAS, Canyon D, Younes MW, Abdel-Wahab H, Mansour AH. A review of botanical phytochemicals with mosquitocidal potential. Environ Int. 2005;31:1149-66. https://doi.org/10.1016/j.envint.2005.03.003
113. Pavela R. Acute and synergistic effects of some monoterpenoid essential oil compounds on the house fly (Musca domestica L.). J Essent Oil Bear Pl. 2008;11:451-9. https://doi.org/10.1080/0972060X.2008.10643653
114. Koul O, Singh R, Kaur B, Kanda D. Comparative study on the behavioral response and acute toxicity of some essential oil compounds and their binary mixtures to larvae of Helicoverpa armigera, Spodoptera litura and Chilo partellus. Ind Crops Prod. 2013;49:428-36. https://doi.org/10.1016/j.indcrop.2013.05.032
115. Hummelbrunner LA, Isman MB. Acute, sublethal, antifeedant, and synergistic effects of monoterpenoid essential oil compounds on the tobacco cutworm, Spodoptera litura (Lep., Noctuidae). J Agricul Food Chem. 2001;49:715-20. https://doi.org/10.1021/jf000749t
116. Liu CH, Mishra AK, Tan RX, Tang C, Yang H, Shen YF. Repellent and insecticidal activities of essential oils from Artemisia princeps and Cinnamomum alcanfora and their effect on seed germination of wheat and broad bean. Bioresour Technol. 2006;97:1969-73. https://doi.org/10.1016/j.biortech.2005.09.002
117. Kostyukovsky M, Rafaeli A, Gileadi C, Demchenko N, Shaaya E. Activation of octopaminergic receptors by essential oil constituents isolated from aromatic plants: Possible mode of action against insect pests. Pest Manag Sci. 2002;58:1101-6. https://doi.org/10.1002/ps.548
118. Wang Z, Kim JR, Wang M, Shu S, Ahn YJ. Larvicidal activity of Cnidium monnieri fruit coumarins and structurally related compounds against insecticide-susceptible and insecticide-resistant Culex pipiens pallens and Aedes aegypti. Pest Manag Sci. 2012;68:1041-7. https://doi.org/10.1002/ps.3265
119. Scotti L, Scotti MT, Silva VB, Santos SR, Cavalcanti SC, Mendonca FJ Jr. Chemometric studies on potential larvicidal compounds against Aedes aegypti. Med Chem. 2014;10:201-10. https://doi.org/10.2174/15734064113099990005
120. Lee S, Peterson CJ, Coats JR. Fumigation toxicity of monoterpenoids to several stored product insects. J Stored Prod Res. 2003;39:77-85. https://doi.org/10.1016/S0022-474X(02)00020-6
121. García M, Donadel OJ, Ardanaz CE, Tonn CE, Sosa ME. Toxic and repellent effects of Baccharis salicifolia essential oil on Tribolium castaneum. Pest Manag Sci. 2005;61:612-8. https://doi.org/10.1002/ps.1028
122. López ó, Fernández-Bolaños JG, Gil MV. New trends in pest control: The search for greener insecticides. Green Chem. 2005;7:431-42. https://doi.org/10.1039/B500733J
123. Santos SR, Melo MA, Cardoso AV, Santos RL, de Sousa DP, Cavalcanti SC. Structure–activity relationships of larvicidal monoterpenes and derivatives against Aedes aegypti Linn. Chemosphere. 2011;84:150-3. https://doi.org/10.1016/j.chemosphere.2011.02.018
124. Abdelgaleil SA, Mohamed MI, Badawy ME, El-arami SA. Fumigant and contact toxicities of monoterpenes to Sitophilus oryzae (L.) and Tribolium castaneum (Herbst) and their inhibitory effects on acetylcholinesterase activity. J Chem Ecol. 2009;35:518-25. https://doi.org/10.1007/s10886-009-9635-3
125. Andrade-Ochoa S, Nevárez-Moorillón GV, SánchezTorres LE, Villanueva-García M, Sánchez-Ramírez BE, Rodríguez-Valdez LM, et al. Quantitative structureactivity relationship of molecules constituent of different essential oils with antimycobacterial activity against Mycobacterium tuberculosis and Mycobacterium bovis. BMC Comp Alt Med. 2015;15:332. https://doi.org/10.1186/s12906-015-0858-2
126. Lomonaco D, Santiago GM, Ferreira YS, Arriaga ÂM, Mazzetto SE, Mele G, et al. Study of technical CNSL and its main components as new green larvicides. Green Chem. 2009;11:31-3. https://doi.org/10.1039/B811504D 127. Wang Z, Song J, Chen J, Song Z, Shang S, Jiang Z, et al. QSAR study of mosquito repellents from terpenoid with a six-member-ring. Bioorg Med Chem Lett. 2008;18:2854-9. https://doi.org/10.1016/j.bmcl.2008.03.091
128. Begum NA, Roy N, Laskar RA, Roy K. Mosquito larvicidal studies of some chalcone analogues and their derived products: Structure–activity relationship analysis. Med Chem Res. 2011;20:184-91. https://doi.org/10.1007/s00044-010-9305-6
129. Ma D, Bhattacharjee AK, Gupta RK, Karle JM. Predicting mosquito repellent potency of N, N-diethyl-m-toluamide (DEET) analogs from molecular electronic properties. Am J Trop Med Hyg. 1999;60:1-6.
130. Paluch G, Grodnitzky J, Bartholomay L, Coats J. Quantitative structure-activity relationship of botanical sesquiterpenes: Spatial and contact repellency to the yellow fever mosquito, Aedes aegypti. J Agric Food Chem. 2009;57:7618-25. https://doi.org/10.1021/jf900964e
131. Rattan RS. Mechanism of action of insecticidal secondary metabolites of plant origin. Crop Protection. 2010;29:91320. https://doi.org/10.1016/j.cropro.2010.05.008
132. Isman MB. Plant essential oils for pest and disease management. Crop Protection. 2000;19:603-8. https://doi.org/10.1016/j.cropro.2010.05.008
133. Zarrad K, Hamouda AB, Chaieb I, Laarif A, Jemâa JM. Chemical composition, fumigant and anti-acetylcholinesterase activity of the Tunisian Citrus aurantium L. essential oils. Ind Crops Prod. 2015;76:121-7. https://doi.org/10.1016/j.indcrop.2015.06.039
134. Houghton PJ, Ren Y, Howes MJ. Acetylcholinesterase inhibitors from plants and fungi. Natural Prod Rep. 2006;23:181-99. https://doi.org/10.1039/B508966M
135. Jyotshna, Srivastava N, Singh B, Chanda D, Shanker K. Chemical composition and acetylcholinesterase inhibitory activity of Artemisia maderaspatana essential oil. Pharm Biol. 2015;53:1677-83. https://doi.org/10.3109/13880209.2014.1001405
136. Enan EE. Insecticidal activity of essential oils: Octopaminergic sites of action. Comp Biochem Physiol C Toxicol Pharmacol. 2001;130:325e337. https://doi.org/10.1016/S1532-0456(01)00255-1
137. Coats R, Karr LL, Drewes CD. Toxicity and neurotoxic effects of monoterpenoids in insects and earthworms. En: Hedin P, editor. Natural occurring pest bioregulators. Washington, D.C.: American Chemical Society; 1991. p.305-16.
138. Ryan MF, Byrne O. Plant-insect coevolution and inhibition of acetylcholinesterase. J Chem Ecol.1988;14:1965-75. https://doi.org/10.1007/BF01013489
139. Praveena A, Sanjayan KP. Inhibition of acetylcholinesterase in three insects of economic importance by linalol, a monoterpene phytochemical. En: Ambrose DP, editor. Insect pest management, a current scenario, entomology research unit. Palayamkottai, India: St. Xavier’s College; 2011. p. 340-5.
140. Felipe CF, Fonsêca KS, dos Reis Barbosa AL, Bezerra JN, Neto MA, de França Fonteles MM, et al. Alterations in behavior and memory induced by the essential oil of Zingiber officinale Roscoe (ginger) in mice are cholinergic dependent. J Med Plants Res. 2008;2:163-70.
141. Yeom HJ, Kang JS, Kim GH, Park IK. Insecticidal and acetylcholine esterase inhibition activity of Apiaceae plant essential oils and their constituents against adults of German cockroach (Blattella germanica). J Agric Food Chem.2012;60:7194-203. https://doi.org/10.1021/jf505927n
142. Kim SW, Kang J, Park IK. Fumigant toxicity of Apiaceae essential oils and their constituents against Sitophilus oryzae and their acetylcholinesterase inhibitory activity. J Asia-Pacific Entomol. 2013;16:443-8. https://doi.org/10. 1016/j.aspen.2013.07.002
143. Seo SM, Jung CS, Kang J, Lee HR, Kim SW, Hyun J, et al. Larvicidal and acetylcholine esterase inhibitory activity of apiaceae plant essential oils and their constituents against Aedes albopictus, and formulation development. J Agric FoodChem.2015;63:9977-86. https://doi.org/10.1021/acs.jafc.5b03586
144. Yeom HJ, Jung CS, Kang J, Kim J, Lee JH, Kim DS, et al. Insecticidal and acetylcholine esterase inhibition activity of asteraceae plant essential oils and their constituents against adults of the German cockroach (Blattella germanica). J Agric FoodChem. 2015;63:2241-8. https://doi.org/10.1021/jf505927n
145. Khanikor B, Parida P, Yadav RNS, Bora D. Comparative mode of action of some terpene compounds against octopamine receptor and acetyl cholinesterase of mosquito and human system by the help of homology modeling and docking studies. J Appl Pharm Sci. 2013;3:6-12. https://doi.org/10.7324/JAPS.2013.30202
146. Unnithan AR. In vitro sensitivity assay of Lantana camara against Aedes agypti with supplementary facts from GC MS and in silico analysis. J Biomed Pharm Sci. 2015;4:5-9.
147. Enan EE. Molecular and pharmacological analysis of an octopamina receptor from American cockroach and fruit fly in response to plant essential oils. Arch Insect Biochem Physiol. 2005;59:161-71. https://doi.org/10.1002/arch.20076
148. Enan EE. Molecular response of Drosophila melanogaster tyramine receptor cascade to plant essential oils. Insect Biochem Mol Biol. 2005;35:309-21. https://doi.org/10.1016/j.ibmb.2004.12.007
149. Priestley CM, Williamson EM, Wafford KA, Sattelle DB. Thymol, a constituent of thyme essential oil, is a positive allosteric modulator of human GABA A receptors and a homo-oligomeric GABA receptor from Drosophila melanogaster. Br J Pharmacol. 2003;140:1363-72. https://doi.org/10.1038/sj.bjp.0705542
150. Bloomquist JR, Boina DR, Chow E, Carlier PR, Reina M, González-Coloma A. Mode of action of the plantderived
silphinenes on insect and mammalian GABA A receptor/chloride channel complex. Pest Biochem Physiol. 2008;91:17-23. https://doi.org/10.1016/j.pestbp.2007.12.002
151. Höld KM, Sirisoma NS, Ikeda T, Narahashi T, Casida JE. a-Thujone (the active component of absinthe): ã-Aminobutyric acid type A receptor modulation and metabolic detoxification. Proc Natl Acad Sci. 2000;97:382631. https://doi.org/10.1073/pnas.070042397
152. Kumar PS, Chezhian A, Raja PS, Sathiyapriya J. Computational selections of terpenes present in the plant Calotropis gigantea as mosquito larvicide’s by blocking the sterol carrying protein, AeSCP-2. Bangladesh J Pharmacol. 2012;7:1-5. https://doi.org/10.3329/bjp.v7i1.8414