PRESENTACIÓN DE CASO
doi: http://dx.doi.org/10.7705/biomedica.v33i1.619
1Departamento de Salud Pública, Universidad Nacional de Colombia, Bogotá, D.C., Colombia
2Departamento Administrativo de Salud de Putumayo, DASALUD, Mocoa, Colombia
Trabajo realizado en el Laboratorio de Entomología Médica, Departamento de Salud Pública, Facultad de Medicina, Universidad Nacional de Colombia.
Contribución de los autores:
Lorena I. Orjuela participó en el trabajo de laboratorio, análisis de datos, revisión de resultados y elaboración del manuscrito.
Manuela Herrera hizo la secuenciación de ITS-2 y COI de los especímenes.
Holmes Erazo recolectó los especímenes en campo, y apoyó la clasificación en series e isofamilias.
Martha L. Quiñones orientó el trabajo en campo y laboratorio, participó en el análisis de datos, en la revisión de resultados y en la elaboración del manuscrito.
Recibido: 24/02/12; aceptado:26/09/12
Introducción. El departamento del Putumayo es una región endémica para malaria, o paludismo, causada principalmente por Plasmodium vivax . Los vectores en esta región incluyen Anopheles darlingi , el cual se ha encontrado solamente en el municipio de Puerto Leguízamo, y recientemente se incriminaron como vectores en Puerto Asís a las especies An. rangeli y An. oswaldoi .
Objetivo. El propósito del trabajo fue determinar el papel de An. benarrochi B en la transmisión de malaria en este departamento, ya que se reporta como la especie más abundante que pica a los humanos.
Materiales y métodos. Se recolectaron larvas y adultos de Anopheles spp. entre el 2006 y el 2008 en los municipios Puerto Leguízamo y Puerto Asís, y se obtuvieron secuencias del gen ITS-2 y del gen mitocondrial COI para confirmar las determinaciones taxonómicas por morfología. Se practicó la prueba ELISA para establecer la infección por P. vivax y P. falciparum.
Resultados. Se identificaron 6.238 individuos correspondientes a 11 especies: An. albitarsis s.l. (1,83 %), An. benarrochi B (72,35 %), An. braziliensis (0,05 %), An. costai (0,06 %), An. darlingi (19,37 %), An. mattogrossensis (0,08 %), An. neomaculipalpus (0,13 %), An. oswaldoi s.l. (0,64 %), An. punctimacula (0,03 %), An. rangeli (5,12 %) y An. triannulatus s.l. (0,34 %). Se evaluaron 5.038 adultos por ELISA y 5 se encontraron positivos para P. vivax 210 y VK 247, todos pertenecientes a la especie An. benarrochi B.
Conclusión. Los resultados sugieren que An. benarrochi B juega un papel en la transmisión de P. vivax en el departamento de Putumayo, dada su alta atracción por los humanos y su infección natural con Plasmodium spp.
Palabras clave: malaria, paludismo insectos vectores, Anopheles , Colombia
doi: http://dx.doi.org/10.7705/biomedica.v33i1.619
Anopheles species present in the department of Putumayo and their natural infectivity with Plasmodium
Introduction: Putumayo is considered an endemic region for malaria transmission, mainly due to Plasmodium vivax. The vectors in this region are Anopheles darlingi , which has been found only in the municipality of Puerto Leguízamo, and An. rangeli and An. oswaldoi s.l. , which were recently incriminated as vectors in Puerto Asís.
Objective: The purpose of this study was to determine the role of An. benarrochi B in malaria transmission in Putumayo, given that it is the most abundant species biting humans.
Materials and methods: Collections of immature and adult stages of Anopheles spp. were made between 2006 and 2008 in the municipalities of Puerto Leguízamo and Puerto Asís in Putumayo, and sequences of internal transcribed spacer 2 ( ITS-2 ) of ribosomal DNA and the mitochondrial gene COI were obtained to confirm the morphological determinations. ELISA was carried out for P. vivax and P. falciparum infectivity.
Results: A total of 6,238 specimens were identified, distributed in 11 species: An. albitarsis s.l. (1.83%), An. benarrochi B (72.35%), An. braziliensis (0.05%), An. costai (0.06%), An. darlingi (19.37%), An. mattogrossensis (0.08%), An. neomaculipalpus (0.13%), An. oswaldoi s.l. (0.64%), An. punctimacula (0.03%), An. rangeli (5.12%), and An. triannulatus s.l. (0.34%). A total of 5,038 adults were assessed by ELISA and 5 were found positive for P. vivax 210 and VK 247, all belonging to An. benarrochi B.
Conclusion: The results suggest that An. benarrochi B plays a role in the transmission of P. vivax in Putumayo due to its high human contact and natural infection with Plasmodium sp.
Key words: malaria, insect vectors, Anopheles , Colombia
doi: http://dx.doi.org/10.7705/biomedica.v33i1.619
En Colombia anualmente se han registrado en promedio 140.000 casos de malaria, o paludismo, en la última década (1), 70 % de los cuales son causados por Plasmodium vivax y el resto casi exclusivamente por P. falciparum (2).
En el departamento de Putumayo se registra anualmente un promedio de 3.800 casos de malaria, y P. vivax es la especie predominante con 95,70 %. Los municipios Puerto Asís y Puerto Leguízamo aportan el 50 % de los casos del departamento, siendo el primero el de mayor reporte, con un promedio de 610 casos al año en la última década. En este municipio, el 98,4 % de los casos los causa P. vivax y, solamente el 1,6 %, P. falciparum , mientras que en Puerto Leguízamo se reporta un número mayor de casos por P. falciparum (12 %) (3).
El índice parasitario anual del departamento presentó un incremento importante entre los años 2000 y 2007, con cifras que están entre 1,76 y 8,27. En este mismo período, los índices parasitarios anuales en los municipios de Puerto Leguízamo y Puerto Asís oscilaron entre 0,13 a 43,06 y 0,11 a 21,4, respectivamente. De acuerdo con estos datos, en el 2007, cuando se desarrolló la mayor parte del presente trabajo, los dos municipios se catalogaron como áreas de alto riesgo (4).
Un estudio anterior para determinar las especies de Anopheles presentes en el departamento de Putumayo, incluyó colecciones de estadios inmaduros y adultos de los municipios Puerto Asís, San Miguel y Puerto Leguízamo (5). Los resultados de las identificaciones por morfología de todos los estadios asociados, reportaron la presencia de 14 especies de Anopheles , entre las que se encontraron, de mayor a menor proporción, las siguientes que picaban a los humanos: una nueva especie designada como An. benarrochi B, por describir (6), An. rangeli Gabaldon, Cova Garcia & López, An. oswaldoi Peryassu, An. triannulatus Neiva & Pinto, An. costai Fonseca & Ramos, An. braziliensis Chagas, An. marajoara Galvao & Damasceno, An. apicimacula Dyar & Knab, An. strodei Root, An. peryassui Dyar & Knab, An. darlingi Root, An. punctimacula Dyar & Knab, An. neomaculipalpus Curry y An. mattogrossensis Lutz & Neiva.
De estas especies solo An. darlingi se considera vector principal de malaria para el país (7). Anopheles darlingi se encontró únicamente en Puerto Leguízamo, en los límites entre los departamentos de Putumayo y Amazonas, donde es considerada la especie responsable de mantener la transmisión de paludismo (5). Quiñones, et al. (5), evaluaron por ELISA 29 individuos pertenecientes a esta especie, pero ninguno resultó positivo para la proteína del circumsporozoíto de Plasmodium spp., posiblemente por el escaso número de especímenes probados. Además, en ese estudio se evaluaron 413 especímenes identificados como An. rangeli y 362 como An. oswaldoi s.l. , de los cuales, 36 fueron positivos a la variante 210 de P. vivax (35 An. rangeli y 1 An. oswaldoi ), para un porcentaje de positivos de 8,19 % y 4,35 %, respectivamente. Debido a estos resultados, las especies An. rangeli y An. oswaldoi s.l. fueron incriminadas como vectores naturales de malaria humana en Putumayo (5).
Durante ese mismo estudio, la especie que pica a los humanos recolectada en mayor proporción (66,10 %) fue An. benarrochi B. Sin embargo, ninguno de estos especímenes se encontró positivo para P. falciparum o P. vivax por ELISA. Estos resultados contrastan con los obtenidos en Perú por Flores, et al. (8), donde An. benarrochi s.l. se encontró naturalmente infectado con P. falciparum y P. vivax en un estudio en el que se evaluaron 62.941 especímenes pertenecientes a esta especie. De acuerdo con los reportes de Quiñones, et al. (5), y Fernández, et al. (9), An. benarrochi B encontrado en Putumayo es morfológicamente similar a los individuos identificados como An. benarrochi s.l . en Perú y que son considerados vectores en los estados de Loreto y Ucayali en límites con Putumayo.
Otras especies, como An. oswaldoi , An. punctimacula , An. neomaculipalpus , An. triannulatus y An. marajoara , también registradas para el departamento, se han encontrado naturalmente infectadas con especies de Plasmodium (5, 8,10-15) y, en algunos casos, se han involucrado en la transmisión del paludismo en el país o en los países que comparten frontera con Colombia, como Perú, Venezuela y Brasil. La importancia de estas especies en la transmisión de malaria en los municipios de Puerto Leguízamo y Puerto Asís del departamento de Putumayo, no se conoce.
Varias de las especies reportadas en el Putumayo pertenecen al subgénero Nyssorhynchus . Este subgénero contiene la mayoría de las especies de Anopheles incriminadas como vectores en Latinoamérica y es el subgénero que más dificultades presenta para la determinación taxonómica cuando se utiliza la morfología de las hembras adultas (16), estadio que se recolecta normalmente durante la vigilancia epidemiológica regular que realizan las secretarías de salud. Además, varias de estas especies son miembros de complejos de especies, como es el caso de An. oswaldoi (Ruiz F, Herrera M, Sallum M, Motoki M, Wilkerson R, Ponsonby D, et al . (2008) Molecular systematics of the Oswaldoi Complex (Anopheles: Nyssorhynchus) in South America. In: The 16th European Society for Vector Ecology Conference, 25 - 28 March 2008, Fitzwilliam College, Cambridge) An. marajoara (17) y An. triannulatus (18), lo cual dificulta aún más su determinación taxonómica.
U n ejemplo que ilustra el problema de la identificación por morfología de las hembras adultas en el departamento de Putumayo es el de An. benarrochi B. Esta especie fue erróneamente identificada como An. evansae Bretes y, posiblemente, como An. oswaldoi (19-21), debido a la variabilidad morfológica que presenta en características normalmente usadas en la diferenciación de estas especies (16,22-24). La identidad de la especie An. benarrochi pudo esclarecerse principalmente con la morfología de los huevos (21) y la morfología del aedeago de los machos, y se describió como una variante morfológica de An. benarrochi (19). Posteriormente, con base en la morfología de los genitales masculinos y con el análisis de secuencias de la región ITS-2 y COI , se identificó como una especie diferente, denominada An. benarrochi B (6).
Estas dificultades para la determinación taxonómica de especies de Anopheles , al utilizar adultos hembra, obstaculizan los estudios sobre su biología y papel como vectores, información útil para la implementación de la vigilancia entomológica y la selección de estrategias de control efectivas y su evaluación, por lo que se hace necesario esclarecer la identidad de las especies de Anopheles presentes, así como su papel como vectores en un área determinada.
El propósito del trabajo fue determinar el papel de An. benarrochi B en la transmisión de malaria en este departamento, ya que se reporta como la especie de mayor abundancia que pica a los humanos.
Materiales y métodos
Los municipios seleccionados para la recolección de mosquitos fueron Puerto Leguízamo, en las localidades La Quebradita (74°40´40.5´´W - 0°19´2.4´´N), La Concepción (75°51´2´´W - 08°11´04´´N), Puntales (74°29´21.5´´W - 0°27´12.1´´N) y El Tablero (75°56´38.7´´W - 0°13´4.4´´N), y Puerto Asís, en la localidad La Manuela (76°32´2´´W - 0°20´2´´N). Los especímenes fueron recolectados por funcionarios del Grupo de Entomología del Departamento Administrativo de Salud, DASALUD (Putumayo), entre noviembre de 2006 y abril de 2008. Se capturaron estadios inmaduros y de adultos de Anopheles spp.
Se hizo una búsqueda en las horas de la mañana, de criaderos existentes alrededor de las viviendas. En cada uno de ellos se recolectaron larvas de tercer y cuarto estadio, siguiendo el método del cucharón mediante 10 "cucharonadas" por cada metro cuadrado de superficie, según la metodología de la Organización Mundial de la Salud (OMS) (25).
Las larvas se mantuvieron vivas individualmente hasta que completaron su desarrollo hasta adulto; de esta forma, se obtuvieron la exuvia de la larva, la pupa y el adulto del mismo ejemplar. Las exuvias se preservaron en viales de 0,5 ml con alcohol al 70 % y los adultos se empacaron en el mismo tipo de vial con la tapa perforada, un ejemplar por vial, y estos, en bolsas de cierre hermético con sílica gel. Este material se transportó al Laboratorio de Entomología Médica de la Facultad de Medicina de la Universidad Nacional de Colombia, sede Bogotá, donde se hicieron los montajes de las pieles de los inmaduros, y de las alas y patas de las hembras, siguiendo la metodología propuesta por González y Carrejo (24).
Los mosquitos adultos hembra se recolectaron sobre humanos con aspiradores bucales, en el peridomicilio y el intradomicilio, entre las 18:00 y las 21:00 y, en algunos casos (cuando la situación de orden público lo permitió), entre las 18:00 y las 06:00. En cada una de las casas trabajaron simultáneamente cuatro personas, dos en el intradomicilio y dos en el peridomicilio. Los recolectores cambiaban de sitio cada hora, para equilibrar el posible sesgo debido a diferencias en atracción y habilidad del personal para las capturas. Cada sitio de muestreo se visitó durante dos a seis días, según las actividades regulares de vigilancia en malaria por parte de los funcionarios de entomología del departamento.
Los mosquitos se guardaron individualmente en viales Eppendorf de 0,5 ml con la tapa perforada y se almacenaron en bolsas con sílica gel, separados según la hora de recolección, la fecha y el sitio de captura. Además, se recolectaron mosquitos del rededor del ganado vacuno en pastoreo, entre las 20:00 y 22:00, durante una semana en agosto de 2007, en dos viviendas de la localidad La Manuela del municipio de Puerto Asís. Estos ejemplares se procesaron de la misma forma que los provenientes de recolecciones con atrayente humano.
Los mosquitos adultos hembra y los ejemplares procedentes de formas inmaduras, junto con sus estadios asociados, se identificaron usando las claves taxonómicas de Faran (16), Faran y Linthicum (22), Suárez, et al. (23), y González y Carrejo (24).
Una muestra de cada especie se seleccionó para secuenciar la región del segundo espaciador transcrito interno ( ITS-2 ) del genoma nuclear, el cual se amplificó usando los cebadores dirigidos contra una secuencia conservada de los genes 5.8S y 28S descritos por Li y Wilkerson (17), y el gen mitocondrial citocromo oxidasa I ( COI ), usando dos conjuntos de cebadores conservados descritos por Lehr, et al. (26). En algunos casos, las muestras provenían de familias establecidas en el laboratorio y determinadas por morfología de todos los estadios asociados; en otros, provenían de las recolecciones hechas con atrayente humano e identificadas por la morfología de las hembras adultas.
A los mosquitos adultos secos, se les extrajo el ADN con el kit de extracción de DNAeasy ™ Blood and Tissue Kit de Qiagen. Para la amplificación por PCR del ITS-2 y de COI se siguieron la metodologías propuestas por Ruiz, et al. (6), y por Lehr, et al. (26), respectivamente. Los productos se visualizaron en un gel de agarosa al 1 %. Los productos se secuenciaron en ambas direcciones usando los dos inciadores ( primers ), directo e inverso. La secuenciación se hizo en el Wadsworth Center Molecular Genetics del New York Health Department. Las secuencias se revisaron y editaron con el programa Sequencher 3.0 ™ (Gene Codes Corp., Ann Arbor, MI, USA), se alinearon y se logró el consenso entre la secuencia directa y la inversa.
Una vez editadas las secuencias, se compararon con las disponibles en el banco de secuencias GenBank , utilizando BLASTN(http://blast.ncbi.nlm.nih.gov), disponible en línea en el NCBI ( National Center for Biotechnology Information ), con el fin de esclarecer las identificaciones morfológicas, con base en los porcentajes de identidad.
PCR-RFLP: los mosquitos adultos hembra identificados morfológicamente como An. benarrochi B o An. oswaldoi , fueron procesados por PCR-RFLP para el espaciador transcrito intergénico 2 ( ITS-2 ), siguiendo la metodología propuesta por Ruiz, et al. (6). Para la RFLP se utilizó la enzima Hae III (Promega ™ ) como endonucleasa de restricción, la cual permitió diferenciar An. benarrochi B de An. oswaldoi , obteniendo un patrón de bandas característico para cada una de las especies. El sitio de corte de esta enzima es 5´...GG/CC...3´ y 3´...CC/GG...5´.
La determinación de la infección natural con Plasmodium spp. se hizo usando la técnica inmunológica ELISA propuesta por Wirtz, et al. (27-29), siguiendo la metodología estándar del protocolo de estuches de ELISA, distribuidos por los Centers for Disease Control and Prevention (CDC), utilizando los anticuerpos monoclonales de P. vivax , VK210 y VK 247, y de P. falciparum .
A cada mosquito identificado se le separó cuidadosamente la cabeza y el tórax del abdomen, para evitar la posibilidad de obtener falsos positivos por presentar ooquistes en el estómago. Similarmente, se removieron las alas y las patas, tratando de evitar la detección de la proteína del circumsporozoíto circulante en la hemolinfa y para disponer de estas partes en la identificación de la especie por morfología y métodos moleculares. Todos los mosquitos, excepto los identificados como An. darlingi , fueron examinados individualmente mediante ELISA; An. darlingi fue examinado en grupos de cinco o menos mosquitos. Los grupos consistieron en mosquitos recolectados en la misma fecha y a la misma hora, en el mismo sitio de captura. Los resultados se leyeron en un lector de ELISA con filtro de 405 nm, después de 30 minutos o una hora. Como punto de corte se usó el doble del promedio de los negativos, el cual ha sido encontrado como el más confiable en evaluaciones de campo (30). Los individuos positivos en una primera ELISA, se confirmaron en una segunda ELISA.
El estudio fue aprobado por el Comité de Ética de la Facultad de Medicina de la Universidad Nacional de Colombia. Se obtuvo consentimiento informado por escrito de los participantes en la metodología propuesta para la recolección de mosquitos sobre atrayente humano. Las personas involucradas fueron técnicos con experiencia del Grupo de Entomología de DASALUD, Putumayo, quienes participaron voluntariamente en el estudio y quienes previamente conocían el protocolo de la Organización Mundial de la Salud para las recolecciones de mosquitos Anopheles .
Resultados
Determinación taxonómica de las especies
Se encontraron tres criaderos permanentes y naturales, uno en la localidad La Concepción, Puerto Leguízamo, y dos en La Manuela, Puerto Asís, en julio y agosto de 2007. Los tres criaderos fueron expuestos al sol y con vegetación emergente. Se realizaron 246 series a partir de las larvas recolectadas en estos criaderos y se identificaron cuatro especies: An. rangeli (n=105), An. triannulatus s.l. (n=72), An. albitarsis s.l . (n=60) y An. braziliensis (n=9).
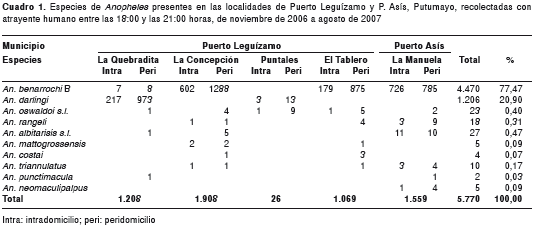
En las capturas de mosquitos adultos se identificaron 11 especies en 6.238 hembras adultas recolectadas. Del total de hembras adultas, 5.770 fueron recolectadas con atrayente humano y, 468, en reposo animal. La especie de Anopheles más frecuente en las recolecciones con atrayente humano fue An. benarrochi B (4.470 individuos, que corresponden al 77,47 % del total de mosquitos identificados), seguida por An. darlingi con 1.208 (20,94 %). Otras especies determinadas en menor proporción fueron An. rangeli (0,31 %), An. albitarsis s.l. (0,43 %), An. oswaldoi s.l. (0,40 %), An. triannulatus s.l. (0,17 %), An. neomaculipalpus (0,09 %), An. mattogrossensis (0,09 %), An. costai (0,07 %) y An. punctimacula (0,03 %). En el cuadro 1 se presenta el total de Anopheles recolectados por localidad y por sitio de captura, en cada uno de los municipios muestreados.

En abrigo animal, las especies recolectadas en mayor proporción fueron An. rangeli (64,53 %), An. albitarsis s.l. (19,02 %) y An. benarrochi B (9,19 %), y en menor proporción, se encontraron An. triannulatus s.l. , An. braziliensis , An. neomaculipalpus y An. oswaldoi s.l. , aportando tan solo el 7,26 % (cuadro 2).
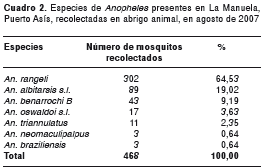
La especie An. benarrochi B se evidenció como muy antropofílica, además de ser tanto endofágica como exofágica, a diferencia de las especies An. rangeli y An. albitarsis s.l. , las cuales mostraron un acentuado comportamiento zoofílico.
Se obtuvieron 54 familias a partir de 200 hembras que se recolectaron en La Manuela, Puerto Asís, las cuales fueron determinadas taxonómicamente por morfología de huevos, de larvas y de adultos hembra. De acuerdo con las determinaciones, se logró el establecimiento de 27 familias de An. benarrochi B, 14 familias de An. rangeli , 7 familias de An. albitarsis s.l. , 3 familias de An. triannulatus s.l. y 1 familia de An. oswaldoi s.l.
Se obtuvieron secuencias para los dos marcadores ( ITS-2 y COI ) de 33 especímenes: 18 An. benarrochi B, 3 An. albitarsis s.l. , 3 An. rangeli , 3 An. triannulatus s.l. , 2 An. punctimacula , 1 An. costai , 2 An. neomaculipalpus , y 1 An. mattogrossensis . De un especimen se obtuvo solamente secuencia de ITS-2 : 1 An. oswaldoi s.l. , y de 19 especímenes de An. darlingi se obtuvieron solamente secuencias de COI . Las secuencias provinieron de especímenes obtenidos a partir de isofamilias y de las recolecciones en campo, determinados preliminarmente por las características morfológicas.
Las secuencias de ITS-2 y COI obtenidas a partir de los especímenes, fueron incluidas en el GenBank con los números de acceso que se presentan a continuación. Para ITS-2, fueron: An. benarrochi B (JX198285 - JX198302), An. albitarsis s.l. (JX198279 - JX198281), An. rangeli ( JX198282 - JX198284), An. triannulatus s.l. (JX198276 - JX198278), An. punctimacula (JX198303 - JX198304), An. costai (JX198308), An. neomaculipalpus (KX198305 - JX198306), An. oswaldoi s.l. (JX198309) y An. mattogrossensis (JX198307). Para COI, fueron: An. benarrochi B (JX205097 - JX205110), An. albitarsis s.l. (JX205114 - JX205116), An. rangeli (JX205117 - JX205120), An. triannulatus s.l. (JX205111 - JX205113), An. punctimacula (JX205122 - JX205123), An. costai (JX205127 - JX205128), An. neomaculipalpus (JX205124 - JX205125), An. mattogrossensis (JX205126) y An. darlingi (JX435780 - JX435797). Las determinaciones preliminares se confirmaron con las comparaciones de las secuencias del GenBank , a excepción de las especies An. punctimacula y An. neomaculipalpus , para las cuales no había secuencias disponibles para comparar. Los resultados se presentan en el cuadro 3.

Un total de 1.067 individuos identificados como An. benarrochi B o An. oswaldoi s.l ., recolectados en las diferentes áreas y periodos de muestreo, se procesaron por PCR-RFLP del ITS-2 del ADN ribosómico. En 1.045 de los individuos se observaron las bandas esperadas para la especie An. benarrochi B (365, 137 y 38 pb). El patrón de corte esperado para An. oswaldoi s.l. (493 y 38 pb) solo se evidenció en 22 de las muestras.
Determinación de la capacidad infecciosa natural de Plasmodium
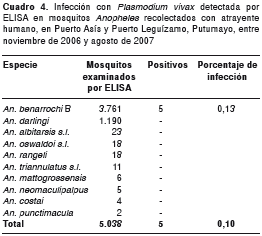
Se examinaron 5.038 especímenes por ELISA. El número de especímenes por especie en los cuales se detectó la proteína del circumsporozoíto se presenta en el cuadro 4. Anopheles benarrochi B fue la única especie encontrada naturalmente infectada con P. vivax 210 y VK 247. Los cinco individuos se recolectaron en el municipio de Puerto Leguízamo, en las localidades La Concepción y El Tablero, a las 18:00 en el intradomicilio y en el peridomicilio. Los especímenes de las demás especies, incluyendo aquellas con antecedentes vectoriales, como An. darlingi , An. rangeli , An. albitarsis s.l. , An. oswaldoi s.l. y An. punctimacula , fueron negativos para la proteína del circumsporozoíto.
Discusión
Durante el desarrollo de este trabajo se encontraron 11 especies de Anopheles ( An. albitarsis s.l. , An. benarrochi B, An. braziliensis , An. costai , An. darlingi , An. mattogrossensis , An. neomaculipalpus , An. oswaldoi s.l. , An. punctimacula , An. rangeli y An. triannulatus s.l. ) en los municipios de Puerto Asís y Puerto Leguízamo, departamento del Putumayo. La especie más abundante recolectada con atrayente humano en todos los periodos de estudio fue An. benarrochi B. Esta especie, pese a su abundancia picando humanos, no se recolectó en ninguno de los hábitats larvarios identificados cerca de las casas, posiblemente por el escaso número de criaderos encontrados o porque los criaderos de esta especie están lejos de las viviendas y en lugares más sombreados. El escaso número de criaderos muestreados no permite hacer inferencias. De acuerdo con este trabajo y con los desarrollados anteriormente por Quiñones, et al. (5), las características de los criaderos de An. benarrochi B hasta el momento no se conocen. Su descripción es necesaria para conocer aspectos de su biología importantes en la toma de decisiones en términos de alternativas para control vectorial.
Anopheles rangeli representó aproximadamente el 62 % de los individuos recolectados en reposo animal; por el contrario, en recolecciones con atrayente humano, solo representó el 0,31 % del total, lo que demuestra un acentuado comportamiento zoofílico y concuerda con lo reportado por Faran (16), quien la describió como una especie que se recolecta principalmente sobre caballos y ganado.
Anopheles darlingi , reconocido vector de paludismo en el país, solo se encontró en el municipio de Puerto Leguízamo, en las localidades La Quebradita y Puntales. Estos resultados están de acuerdo con la distribución reportada para esta especie en trabajos desarrollados anteriormente en el departamento del Putumayo, los cuales la restringen a los límites con el Amazonas y la responsabilizan de mantener el principal foco de transmisión de P. falciparum (5).
Se confirmó la identidad de las especies al compararlas con las secuencias de ITS-2 del ADNr y el gen COI del ADNmt disponibles en el GenBank . Esto demuestra la utilidad de esta metodología, la cual, en conjunto con la observación de caracteres morfológicos de los estadios asociados de huevo, larva, pupa y adulto, se constituyen en una herramienta útil que permite la determinación de especies pertenecientes a complejos, siendo particularmente relevante en estudios de incriminación de vectores de malaria, donde es necesaria una correcta determinación de los especímenes. Sin embargo, aún varios de los complejos están por ser resueltos, como es el caso del complejo An. albitarsis s.l. , An. oswaldoi s.l. y , An. triannulatus s.l. , y de otras especies no se encontraron secuencias disponibles en el GenBank para hacer comparaciones, como fueron An. punctimacula y An. neomaculipalpus . Las determinaciones taxonómicas para estas especies se basaron en la morfología de los estados asociados y de las hembras adultas, y se aportaron las secuencias al GenBank lo que facilitará trabajos futuros.
Las secuencias de ITS-2 asociadas a isofamilias de An. benarrochi B mostraron un 100 % de identidad con las secuencias sometidas por Ruiz, et al. , 2005, para este mismo departamento. Las evidencias morfológicas, moleculares y de comportamiento, discutidas por Ruiz, et al. (6), y acumuladas durante los trabajos desarrollados anteriormente en el Putumayo, sustentan la necesidad de describir la especie que hasta ahora se ha venido denominando An. benarrochi B. Sallum, et al. (31), discute la necesidad de establecer la definición morfológica y molecular de las especies del complejo An. benarrochi s.l. para resolver el estatus taxonómico de las poblaciones encontradas en Brasil, Perú y Colombia, dado que se han encontrado diferencias en la morfología de los genitales de los machos y en el ITS-2 del ADNr de An. benarrochi de Acrelandia, Acre, Brasil, con las de Putumayo sometidas por Ruiz, et al. (6).
Con relación al complejo An. oswaldoi s.l. , Ruiz, et al. (Ruiz F, Herrera M, Sallum M, Motoki M, Wilkerson R, Ponsonby D, et al . Molecular systematics of the Oswaldoi Complex (Anopheles: Nyssorhynchus) in South America. In: The 16th European Society for Vector Ecology Conference, March 25-28, 2008, Fitzwilliam College, Cambridge) diferenciaron cuatro especies, a saber, An. oswaldoi s.s ., y An. oswaldoi A, B y C, con base en la morfología de los genitales de los machos y en secuencias de ITS-2 y COI, y propusieron su distribución así: en Brasil, An. oswaldoi s.s ., A y B; en Colombia, An. oswaldoi A, B y C; en Ecuador, An. oswaldoi B y C; en Perú, An. oswaldoi C; y en Trinidad y Venezuela, An. oswaldoi B. Infortunadamente, las secuencias de estos especímenes aún no están disponibles en el GenBank , por lo que no fue posible comparar las secuencias de los especímenes obtenidas en este trabajo. Al comparar estas secuencias con las del GenBank , correspondientes a la descripción reiterada de An. oswaldoi s.s. de muestras provenientes de Espirito Santo y São Paulo (Brasil) (números de acceso EF457228-EF457239), se demuestra una identidad del 97 %, lo cual sugiere que la especie de An. oswaldoi s.l. presente en el Putumayo es probablemente otra de este complejo.
Para el complejo An.albitarsis s.l. , se han descrito seis especies: An. albitarsis Lynch-Arribálzaga, An. deaneorum Rosa-Freitas , An. marajoara Galvão y Damasceno, An. oryzalimnetes Wilkerson y Motoki, An. janconnae Wilkerson y Sallum y An. albitarsis F (32), de las cuales, en Colombia se han reportado An. marajoara , An. albitarsis F (33); y, recientemente, Gutiérrez, et al. (32), al analizar especímenes de la Costa Caribe de Colombia, describió un linaje cercano a An. janconnae . Las secuencias de Putumayo presentaron una homología del 99 % con An. marajoara , tanto por ITS-2 como por COI . Sin embargo, mostraron también una gran homología con An. albitarsis F. Debido a la complejidad que presenta la discriminación de las especies de este complejo y a la necesidad de realizar estudios más completos y a mayor escala que involucren las especies a lo largo de su distribución en Latinoamérica, la identidad de la especie presente en Putumayo no es clara y se clasifica como An. albitarsis s.l.
En este trabajo, la especie An. benarrochi B se encontró naturalmente infectada mediante la proteína del circumsporozoíto de P. vivax (VK 210 y VK 247), con una tasa de infección total de 0,13 %, dos de ellos infectados con P. vivax 210 y tres con P. vivax 247. Esta tasa de infección es más baja que la reportada para especies consideradas vectores primarios, como An. darlingi (entre 0,98 % y 2,1 %) (8,34), lo cual podría explicar por qué An. benarrochi B no se había encontrado infectada en los anteriores estudios en el departamento, y es comparable con la obtenida para esta misma especie en los estados de Loreto y Ucayali (Perú) (0,14 % en 6.323 grupos de mosquitos evaluados), donde cumple un importante papel en la transmisión del paludismo (8). Que esta especie haya sido encontrada naturalmente infectada únicamente con parásitos de P. vivax , no es sorprendente, dado que en los últimos siete años los casos de malaria reportados por el departamento se deben principalmente a esta especie de Plasmodium , y particularmente para el año 2007, durante el cual se recolectó el mayor número de especímenes de Anopheles aquí evaluados, el 97,20 % de los casos diagnosticados fueron causados por P. vivax . Además, estos resultados también podrían sugerir que la longevidad de esta especie no es suficiente como para soportar el desarrollo de P. falciparum .
Los cinco An. benarrochi B positivos fueron recolectados en agosto en tres días diferentes, tanto en el intradomicilio como en el peridomicilio, entre las 18:00 y las 19:00, periodo en que los habitantes de la zona están afuera de sus casas. En los estudios de Quiñones, et al. (5), el pico de actividad de esta especie se estableció entre las 18:00 y las 24:00. Estos resultados tienen implicaciones importantes para el control de la malaria en esta región y, dada la abundancia de esta especie y su asociación con los humanos, se puede recomendar la implementación de métodos de protección personal, tales como el uso de repelentes y de toldillos para disminuir el contacto entre los humanos y el vector.
En el muestreo en La Quebradita, Puerto Leguízamo, la especie más abundante fue An. darlingi , reconocida como vector primario en el país (15,35) y la cual ha sido encontrada naturalmente infectada con esporozoítos de P. falciparum , P. vivax 210 y P. vivax 247 a lo largo y ancho de la Amazonia, con tasas de infección que varían entre 2,7 y 22,4 % (8,15,33,36-38). En este estudio, An. darlingi no se encontró naturalmente infectada con ninguna de las especies de Plasmodium evaluadas, resultado similar al obtenido en estudios previos de infección natural en el departamento (5). Sin embargo, cabe destacar que los individuos que se evaluaron solo correspondían a los recolectados durante un mes.
Los resultados del presente trabajo sugieren que la nueva especie, hasta ahora designada como An. benarrochi B, puede jugar un papel importante en la transmisión de malaria en el departamento del Putumayo, dada su gran antropofilia y a que se encontró naturalmente infectada con P. vivax . Estos hallazgos se suman a los obtenidos por Quiñones, et al. (5), quienes incriminan a An. oswaldoi s.l. y a An. rangeli como vectores en el departamento, demostrando la heterogeneidad que los vectores de malaria pueden exhibir en una región en particular. Se requieren estudios posteriores que permitan describir y saber más de la biología de este nuevo vector de malaria en Colombia, como son los tipos de criaderos, el estado de vulnerabilidad ante los insecticidas y su capacidad vectorial, información que será de utilidad para la selección y evaluación entomológica de las medidas de control de malaria por parte de la secretaría de salud del Putumayo.
A los funcionarios de la Dirección Administrativa de Salud de Putumayo (DASALUD), por la colaboración para el trabajo de campo, particularmente a Ignacio Palacios y al Grupo de Entomología; a las comunidades de los municipios de Puerto Asís y Puerto Leguízamo, por permitir el ingreso a sus casas durante el muestreo; a Lucas A. Alcalá, por el apoyo en el procesamiento de las muestras en el laboratorio; a Robert Wirtz, por la donación de los anticuerpos monoclonales para el desarrollo de la técnica ELISA para determinar la infección natural en mosquitos por parásitos del género Plasmodium spp.; y a Jan Conn, por el apoyo con la secuencias de los especímenes.
Los autores manifestamos no tener conflictos de intereses en esta publicación.
Este proyecto fue financiado por Colciencias, código 110134319196.
Correspondencia: Sonia Isabel Cuervo, Grupo de Infectología, Instituto Nacional de Cancerología, Empresa Social del Estado, Avenida calle 1ª N° 9-85, Bogotá, D.C., Colombia, Teléfono: (051) 334 1111, extensión 5558 scuervo@cancer.gov.co y sicuervom@unal.edu.co
1. World Health Organization. World Malaria Report 2010. Ginebra: World Health Organization; 2010. p. 1-204.
2. Padilla-Rodríguez JC, Uribe GÁ, Araújo RM, Narváez PC, Valencia SH. Epidemiology and control of malaria in Colombia. Mem Inst Oswaldo Cruz. 2011;106(Suppl.1):114-22. http://dx.doi.org/10.1590/S0074-02762011000900015
3. Peña MY, Revelo D, Ordóñez LJ, López MC, Aguilera G. Comportamiento epidemiológico de malaria en el departamento de Putumayo. Fecha de consulta: 14 de junio de 2012. Disponible en: http://www.orasconhu.org/documentos/Anexo%2014y%20COL%20M&E%202009.pdf.
4. Departamento Administrativo de Salud Putumayo. Informe casos de malaria por localidad, periodo y grupos de edad 2000-2007. Mocoa: DASALUD Putumayo; 2007. p. 1-32.
5. Quiñones ML, Ruiz F, Calle DA, Harbach RE, Erazo HF, Linton YM. Incrimination of Anopheles (Nyssorhynchus) rangeli and An. (Nys.) oswaldoi as natural vectors of Plasmodium vivax in Southern Colombia. Mem Inst Oswaldo Cruz. 2006;101:617-23. http://dx.doi.org/10.1590/S0074-02762006000600007
6. Ruiz F, Quiñones ML, Erazo HF, Calle DA, Alzate JF, Linton YM. Molecular differentiation of Anopheles (Nyssorhynchus) benarrochi and An. oswaldoi from Southern Colombia. Mem Inst Oswaldo Cruz. 2005;100:155-60. http://dx.doi.org/10.1590/S0074-02762005000200008
7. Olano V, Brochero H, Sáenz R, Quiñones M, Molina J. Mapas preliminares de la distribución de Anopheles vectores de malaria en Colombia. Biomédica. 2001;21:402-83.
8. Florez C, Fernández R, Escobedo KS, Vela Q, Schoeler GB. Natural Plasmodium infections in Anopheles darlingi and Anopheles benarrochi (Diptera: Culicidae) from Eastern Peru. J Med Entomol. 2004;41:489-94. http://dx.doi.org/10.1603/0022-2585-41.3.489
9. Fernández LR, Schoeler G, Stancil J. Presencia de Anopheles (Nyssorhynchus) benarrochi en áreas de selva con transmisión malárica. Rev Peru Med Exp Salud Pública. 2004;21:217-22.
10. Branquinho MS, Araújo MS, Natal D, Marelli MT, Rocha RM, Taveira FA, et al. Anopheles oswaldoi a potential malaria vector in Acre, Brazil. Trans R Soc Trop Med Hyg. 1996;90:233.
11. Hayes J, Calderón G, Falcon R, Zambrano V. Newly incriminated Anopheles vectors of human malaria parasites in Junin Department, Peru. J Am Mosq Control Assoc. 1987;33:418-22.
12. Rubio-Palis Y, Curtis CF. Biting and resting behaviour of anophelines in western Venezuela and implications for control of malaria transmission. Med Vet Entomol. 1992;6:375-81.
13. Povoa MM, Wirtz RA, Lacerda RNL, Miles MA, Warhust D. Malaria vectors in the municipality of Serra do Navio, state of Amapá, Amazon Region, Brazil. Mem Inst Oswaldo Cruz. 2001;96:179-84. http://dx.doi.org/10.1590/S0074-02762001000200008
14. Moreno JE, Rubio-Palis Y, Páez E, Perez E, Sánchez V, Vaccari E. Anopheles (Anopheles) neomaculipalpus : A new malaria vector in the Amazon basin?. Med Vet Entomol. 2005;19:329-32. http://dx.doi.org/10.1111/j.1365-2915.2005.00572.x
15. Herrera S, Suárez M, Sánchez G, Quiñones M, Herrera M. Uso de la técnica inmunoradiométrica (IRMA) en Anopheles de Colombia para la identificación de esporozoítos de Plasmodium . Colombia Médica. 1987;18:57-60.
16. Faran ME. A revision of the Albimanus section of the subgenus Nyssorhynchus of Anopheles . Contrib Am Entomol Inst. 1980;15:1-125.
17. Li C, Wilkerson RC. Identification of Anopheles (Nyssorhynchus) albitarsis complex species (Diptera: Culicidae) using rDNA internal transcribed spacer 2-based polymerase chain reaction primes. Mem Inst Oswaldo Cruz. 2005;100:495-500. http://dx.doi.org/10.1590/S0074-02762005000500009
18. Silva Do Nascimento TF, Wilkerson RC, Lourenco-De-Oliveira R, Monteiro FA. Molecular confirmation of the specific status of Anopheles halophylus (Diptera: Culicidae) and evidence of a new criptic species within An. triannulatus in central Brazil. J Med Entomol. 2006;43:455-9. http://dx.doi.org/10.1603/0022-2585(2006)43[455: MCOTSS]2.0.CO;2
19. Quiñones ML, Harbach RE, Calle DA, Ruiz JF, Erazo HF, Linton YM. Variante morfológica de adultos hembra de Anopheles benarrochi (Diptera: Culicidae) en Putumayo, Colombia. Biomédica. 2001;21:351-9.
20. Calle DA, Quiñones ML, Erazo H, Jaramillo N. Morphometric discrimination of females of five species of Anopheles of the subgenus Nyssorhynchus from Southern and Northwest Colombia. Mem Inst Oswaldo Cruz. 2002;97:1191-5. http://dx.doi.org/10.1590/S0074-02762002000800021
21. Estrada D, Quiñones ML, Sierra D, Calle D, Ruiz F, Erazo H, et al. Utilidad de la morfología de los huevos como un método indirecto para identificar Anopheles benarrochi Gabaldon, Cova García & Lopez, Anopheles oswaldoi (Peryassu) y Anopheles rangeli Gabaldon, Cova García & Lopez, (Diptera:Culicidae) en Putumayo, Colombia. Biomédica. 2003;23:388-95.
22. Faran ME, Linthicum KJ. A handbook of the Amazonian species of Anopheles ( Nyssorhynchus ) (Diptera, culicidae). Mosq Syst. 1981;13:1-81.
23. Suárez MF, Quiñones ML, Fleming GA, Robayo M. Guía introductoria a la morfología de Anopheles y clave para determinación de las principales especies de Colombia, DCD. Bogotá, D.C.: Ministerio de Salud; 1987. p. 43.
24. González R, Carrejo N. Introducción al estudio taxonómico de Anopheles de Colombia – Claves taxonómicas y notas de distribución. Cali: Universidad del Valle; 2007. p. 63.
25. World Health Organization. Manual on practical entomology in malaria. Geneva: WHO; 1975.
26. Lehr MA, Kilpatrick CW, Wilkerson RC, Conn JE. Cryptic species in the Anopheles ( Nyssorhynchus ) albitarsis (Diptera: Culicidae) complex: Incongruence between random amplified polymorphic DNA-polymerase chain reaction identification and analysis of mitochondrial DNA COI gene sequences. Ann Entomol Soc Am. 2005;98:908-17. http://dx.doi.org/10.1603/0013-8746(2005)098[0908:CSITAN]2.0.CO;2
27. Wirtz RA, Burkot TR, Andre RG, Rosenberg R, Collins WE, Roberts DR. Identification of Plasmodium vivax sporozoites in mosquitoes using an enzyme-linked immuno-sorbent assay. Am J Trop Med Hyg. 1985;34:1048-54.
28. Wirtz RA, Zavala F, Charoenvit Y, Campbell GH, Burkot TR, Schneider I, et al. Comparative testing of monoclonal antibodies against Plasmodium falciparum sporozoites for ELISA development. Bull World Health Org. 1987;65:39-45 .
29. Wirtz RA, Sattabongkot J, Hall T, Burkot TR, Rosenberg R. Development and evaluation of an enzyme – linked immunosorbent assay for Plasmodium vivax VK 247 sporozoites. J Med Entomol. 1992;29:854-7.
30. Beier MS, Schwartz IK, Beier JC, Perkins PV, Onyango F, Koros JK, et al. Identification of malaria species by ELISA in sporozoite and Oocyst infected Anopheles from Western Kenya. Am J Trop Med Hyg. 1988;39:323-7.
31. Sallum MA, Marrelli MT, Nagaki SS, Laporta GZ, Dos Santos CL. Insight into Anopheles ( Nyssorhynchus ) (Diptera: Culicidae) species from Brazil. J Med Entomol. 2008;45:970-81. http://dx.doi.org/10.1603/0022-2585(2008)45[970:IIANDC]2.0.CO;2
32. Gutiérrez LA, Orrego LM, Gómez GF, López A, Luckhart S, Conn JE, et al. A new mtDNA COI gene lineage near An. janconnae of the Albitarsis Complex from Caribbean Colombia. Mem Inst Oswaldo Cruz. 2010;105:1019-25. http://dx.doi.org/10.1590/S0074-02762010000800011
33. Brochero HM, Li C, Wilkerson RC. A newly recognized species in the Anopheles (Nyssorhynchus) albitarsis complex (Diptera: Culicidae) from Puerto Carreño, Colombia. Am J Trop Med Hyg. 2007;76:1113-7.
34. Povoa MM, Conn JE, Schlichting CD, Amaral JC, Nazaré M, Segura O, et al. Malaria vectors, epidemiology, and the re-emergence of Anopheles darlingi in Belem, Pará, Brazil. J Med Entomol. 2003;40:379-86. http://dx.doi.org/10.1603/0022-2585-40.4.379
35. Elliot R. The influence of vector behavior on malaria transmission. Am J Trop Med Hyg. 1972;21:755-63.
36. Da Rocha JA, De Oliveira SB, Povoa MM, Moreira LA, Krettli AU. Malaria vectors in areas of Plasmodium falciparum epidemic transmission in the Amazon region, Brazil. Am J Trop Med Hyg. 2008;78:872-7.
37. De Arruda M, Carvalho MB, Nussenzweig RS, Maracic M, Ferreira AW, Cochrane AH. Potential vectors of malaria and their different susceptibility to Plasmodium falciparum and Plasmodium vivax in northern Brazil identified by immunoassay. Am J Trop Med Hyg. 1986;35:873-81.
38. Tadey WP, Thatcher D. Malaria vectors in the Brazilian Amazon: Anopheles of subgenus Nyssorhynchus . Rev Inst Med Trop Sao Paulo. 2000;42:87-94. http://dx.doi.org/10.1590/S0036-46652000000200005