Evaluación del daño oxidativo y por metilación del ADN de pintores expuestos ocupacionalmente a solventes orgánicos y pinturas
Resumen
Introducción. La exposición a solventes orgánicos y pinturas se ha asociado con efectos genotóxicos y mayor riesgo de neoplasias. Sin embargo, aún no se ha caracterizado bien el tipo de daño que esta exposición induce en el ADN humano, ni los mecanismos por los cuales se genera. Uno de los grupos con mayor exposición a dichos solventes y pinturas son los pintores de automóviles del sector informal que trabajan sin adecuadas prácticas de seguridad ocupacional.
Objetivo. Determinar el daño oxidativo y por metilación del ADN de linfocitos de pintores de automóviles expuestos a solventes orgánicos y pinturas.
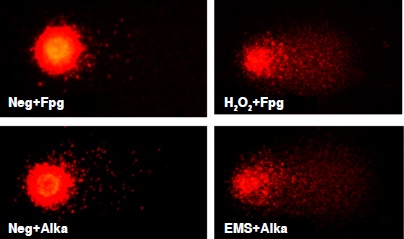
Materiales y métodos. Se analizaron linfocitos aislados de sangre periférica de 62 pintores y 62 sujetos no expuestos mediante el ensayo cometa de gran eficiencia acoplado a las enzimas Fpg y AlkA. Las categorías de daño en el ADN evaluadas fueron el daño basal (sin enzimas), el daño oxidativo y el daño por metilación, y el parámetro de medición, el porcentaje de ADN en la cola.
Resultados. El porcentaje de ADN en la cola fue mayor en el grupo expuesto con respecto al no expuesto (p<0,05). En el grupo expuesto, dicho porcentaje fue mayor en la categoría de daño oxidativo comparado con la del basal (16,50 Vs. 12,87; p<0,001), en tanto que en el daño por metilación no se encontraron diferencias significativas (14,00 Vs. 12,87; p>0,05).
Conclusión. La exposición a solventes orgánicos y pinturas se asoció con el aumento de las lesiones oxidativas del ADN de los linfocitos de pintores de automóviles, tales como la producción de 8-oxo-2’-desoxiguanosina (8-oxodG) y otros productos formamidopirimidina, los cuales se consideran considerablemente mutagénicos.
Descargas
Referencias bibliográficas
International Agency for Research on Cancer. Painting, firefighting, and shiftwork: Occupational exposure as a painter. IARC Monogr Eval Carcinog Risks Hum. Lyon, France: International Agency for Research on Cancer; 2010. p. 42-394.
Moro AM, Brucker N, Charao M, Bulcao R, Freitas F, Baierle M, et al. Evaluation of genotoxicity and oxidative damage in painters exposed to low levels of toluene. Mutat Res Genet Toxicol Environ Mutagen. 2012;746:42-8. https://doi.org/10.1016/j.mrgentox.2012.02.007
Cassini C, Calloni C, Bortolini G, García S, Dornelles M, Henriques J, et al. Occupational risk assessment of oxidative stress and genotoxicity in workers exposed to paints during a working week. Int J Occup Environ Health. 2011;24:308-19. https://doi.org/10.2478/s13382-011-0030-2
Londoño-Velasco E, Hidalgo-Cerón V, Escobar-Hoyos LF, Hoyos-Giraldo LS. Assessment of genomic damage and repair on human lymphocytes by paint thinner in vitro. Toxicol Mech Methods. 2014;24:243-9. PubMed PMID: 24236478. https://doi.org/10.3109/15376516.2013.862893
Costa C, De Pasquale R, Silvari V, Barbaro M, Catania S. In vitro evaluation of oxidative damage from organic solvent vapours on human skin. Toxicol In Vitro. 2006;20:324-31. https://doi.org/10.1016/j.tiv.2005.08.007
Martínez-Alfaro M, Palma-Tirado L, Sandoval-Zapata F, Carabez-Trejo A. Correlation between formamidopyrimidine DNA glycosylase (Fpg)-sensitive sites determined by a comet assay, increased MDA, and decreased glutathione during long exposure to thinner inhalation. Toxicol Lett. 2006;163:198-205. https://doi.org/10.1016/j.toxlet.2005.10.021
Hoyos-Giraldo LS, Carvajal S, Cajas-Salazar N, Ruiz M, Sánchez-Gómez A. Chromosome aberrations in workers exposed to organic solvents: Influence of polymorphisms in xenobiotic-metabolism and DNA repair genes. Mutat Res. 2009;666:8-15. https://doi.org/10.1016/j.mrfmmm.2009.03.003
Testa A, Festa F, Ranaldi R, Giachelia M, Tirindelli D, De Marco A, et al. A multi-biomarker analysis of DNA damage in automobile painters. Environ Mol Mutagen. 2005;46:182-8. https://doi.org/10.1002/em.20147
Aksoy H, Yilmaz S, Celik M, Yuzbasioglu D, Unal F. Genotoxicity study in lymphocytes of offset printing workers. J Appl Toxicol. 2006;26:10-5. https://doi.org/10.1002/jat.1098
Villalba-Campos M, Ramírez-Clavijo SR, Sánchez-Corredor MC, Rondón-Lagos M, Ibáñez-Pinilla M, Palma RM, et al. Quantification of cell-free DNA for evaluating genotoxic damage from occupational exposure to car paints. J Occup Med Toxicol. 2016;11:33. https://doi.org/10.1186%2Fs12995-016-0123-8
Londoño-Velasco E, Martínez-Perafán F, Carvajal-Varona S, García-Vallejo F, Hoyos- Giraldo LS. Assessment of DNA damage in car spray painters exposed to organic solvents by the high-throughput comet assay. Toxicol Mech Methods. 2016;26:238-42. https://doi.org/10.3109/15376516.2016.1158892
Collins A, Duthie S, Dobson V. Direct enzymic detection of endogenous oxidative base damage in human lymphocyte DNA. Carcinogenesis. 1993;14:1733.
Tice RR, Agurell E, Anderson D, Burlinson B, Hartmann A, Kobayashi H, et al. Single cell gel/comet assay: Guidelines for in vitro and in vivo genetic toxicology testing. Environ Mol Mutagen. 2000;35:206-21.
Collins AR, Dusinska M, Horska A. Detection of alkylation damage in human lymphocyte DNA with the comet assay. Acta Biochim Pol. 2001;48:611-4.
Blasiak J, Arabski M, Krupa R, Wozniak K, Rykala J, Kolacinska A, et al. Basal, oxidative and alkylative DNA damage, DNA repair efficacy and mutagen sensitivity in breast cancer. Mutat Res. 2004;554:139-48. https://doi.org/10.1016/j.mrfmmm.2004.04.001
World Medical Association. World Medical Association Declaration of Helsinki. Ethical principles for medical research involving human subjects. Bull World Health Organ. 2001;79:373-4.
World Health Organization. Standards and operational guidance for ethics review of health related research with human participants. Geneva: World Health Organization; 2011. p. 55.
Ministerio de Salud. Resolución Número 8430 de 1993 (4 de octubre). Normas científicas, técnicas y administrativas para la investigación en salud. Santafé de Bogotá: Ministerio de Salud; 1993. p. 19.
Singh NP, McCoy MT, Tice RR, Schneider EL. A simple technique for quantitation of low levels of DNA damage in individual cells. Exp Cell Res. 1988;175:184-91.
Azqueta A, Gutzkow KB, Priestley CC, Meier S, Walker JS, Brunborg G, et al. A comparative performance test of standard, medium- and high-throughput comet assays. Toxicol In Vitro. 2013;27:768-73. https://doi.org/10.1016/j.tiv.2012.12.006
Gutzkow KB, Langleite TM, Meier S, Graupner A, Collins AR, Brunborg G. High-throughput comet assay using 96 minigels. Mutagenesis. 2013;28:333-40. https://doi.org/10.1093/mutage/get012
Lynge E, Anttila A, Hemminki K. Organic solvents and cancer. Cancer Causes Control. 1997;8:406-19.
Ministerio de Salud y Protección Social, Instituto Nacional de Cancerología. Plan Nacional para el control del Cáncer en Colombia, 2012. Fecha de consulta: 14 de septiembre de 2018. Disponible en: https://www.minsalud.gov.co/sites/rid/Lists/BibliotecaDigital/RIDE/IA/INCA/plan-nacional-control-cancer.pdf
Wogan GN, Hecht SS, Felton JS, Conney AH, Loeb LA, editors. Environmental and chemical carcinogenesis, 2004: Elsevier. p. 473-486.
Clapp RW, Howe GK, Jacobs MM. Environmental and occupational causes of cancer: A call to act on what we know. Biomed Pharmacother. 2007;61:631-9. https://doi.org/10.1016/j.biopha.2007.08.001
International Agency for Research on Cancer. Chemical agents and related occupations: Occupational exposure as a painter. IARC Monographs on the Evaluation of Carcinogenic Risk of Chemicals to Humans. Lyon: International Agency for Research on Cancer IARC. Working Group on the Evaluation of Carcinogenic Risk to Humans; 2012. p. 509 - 39.
Brown LM, Moradi T, Gridley G, Plato N, Dosemeci M, Fraumeni JF. Exposures in the painting trades and paint manufacturing industry and risk of cancer among men and women in Sweden. J Occup Environ Med. 2002;44:258-64.
Ramanakumar AV, Parent ME, Richardson L, Siemiatycki J. Exposures in painting-related occupations and risk of lung cancer among men: Results from two case-control studies in Montreal. Occup Environ Med. 2011;68:44-51. https://doi.org/10.1136/oem.2009.049957
Alguacil J, Porta M, Malats N, Kauppinen T, Kogevinas M, Benavides FG, et al. Occupational exposure to organic solvents and K-ras mutations in exocrine pancreatic cancer. Carcinogenesis. 2002;23:101-6.
Murata M, Tsujikawa M, Kawanishi S. Oxidative DNA damage by minor metabolites of toluene may lead to carcinogenesis and reproductive dysfunction. Biochem Biophys Res Commun. 1999;261:478-83. https://doi.org/10.1006/bbrc.1999.1041
Midorikawa K, Uchida T, Okamoto Y, Toda C, Sakai Y, Ueda K, et al. Metabolic activation of carcinogenic ethylbenzene leads to oxidative DNA damage. Chem Biol Interact. 2004;150:271-81. https://doi.org/10.1016/j.cbi.2004.09.020
Gaikwad NW, Bodell WJ. Formation of DNA adducts in HL-60 cells treated with the toluene metabolite p-cresol: A potential biomarker for toluene exposure. Chem-Biol Interact. 2003;145:149-58.
Dizdaroglu M. Oxidatively induced DNA damage: Mechanisms, repair, and disease. Cancer Lett. 2012;327:26-47. https://doi.org/10.1016/j.canlet.2012.01.016
Bruner SD, Norman D, Verdine GL. Structural basis for recognition and repair of the endogenous mutagen 8-oxoguanine in DNA. Nature. 2000;403:859. https://doi.org/10.1038/35002510
Kino K, Sugiyama H. Possible cause of G --> C transversion mutation by guanine oxidation product, imidazolone. Chem Biol. 2001;8:369-78.
Arabski M, Klupinska G, Chojnacki J, Kazmierczak P, Wisniewska-Jarosinska M, Drzewoski J, et al. DNA damage and repair in Helicobacter pylori-infected gastric mucosa cells. Mutat Res. 2005;570:129-35. https://doi.org/10.1016/j.mrfmmm.2004.10.006
Hoyos-Giraldo LS, Escobar-Hoyos LF, Saavedra-Trujillo D, Reyes-Carvajal I, Muñoz A, Londoño-Velasco E, et al. Gene-specific promoter methylation is associated with micronuclei frequency in urothelial cells from individuals exposed to organic solvents and paints. J Expo Sci Environ Epidemiol. 2016;26:257-62. https://doi.org/10.1038/jes.2015.28
Moller P. Assessment of reference values for DNA damage detected by the comet assay in human blood cell DNA. Mutat Res. 2006;612:84-104. https://doi.org/10.1016/j.mrrev.2005.10.001
Mladinic M, Kopjar N, Milic M, Dasovic AB, Huzak M, Zeljezic D. Genomic instability in a healthy elderly population: A pilot study of possible cytogenetic markers related to ageing. Mutagenesis. 2010;25:455-62. https://doi.org/10.1093/mutage/geq027
Fracasso ME, Doria D, Carrieri M, Bartolucci GB, Quintavalle S, De Rosa E. DNA single and double-strand breaks by alkaline- and immuno-comet assay in lymphocytes of workers exposed to styrene. Toxicol Lett. 2009;185:9-15. https://doi.org/10.1016/j.toxlet.2008.11.010
Sul D, Lee D, Im H, Oh E, Kim J, Lee E. Single strand DNA breaks in T- and B-lymphocytes and granulocytes in workers exposed to benzene. Toxicol Lett. 2002;134:87-95.
Roma-Torres J, Teixeira JP, Silva S, Laffon B, Cunha LM, Méndez J, et al. Evaluation of genotoxicity in a group of workers from a petroleum refinery aromatics plant. Mutat Res. 2006;604:19-27. https://doi.org/10.1016/j.mrgentox.2005.12.005
Sardas S, Omurtag GZ, Tozan A, Gul H, Beyoglu D. Evaluation of DNA damage in construction-site workers occupationally exposed to welding fumes and solvent-based paints in Turkey. Toxicol Ind Health. 2010;26:601-8. https://doi.org/10.1177/0748233710374463
Zhu CQ, Lam TH, Jiang CQ. Lymphocyte DNA damage in bus manufacturing workers. Mutat Res Genet Toxicol Environ Mutagen. 2001;491:173-81.
Bonassi S, Znaor A, Ceppi M, Lando C, Chang WP, Holland N, et al. An increased micronucleus frequency in peripheral blood lymphocytes predicts the risk of cancer in humans. Carcinogenesis. 2006;28:625. https://doi.org/10.1093/carcin/bgl177
Bonassi S, Hagmar L, Stromberg U, Montagud AH, Tinnerberg H, Forni A, et al. Chromosomal aberrations in lymphocytes predict human cancer independently of exposure to carcinogens. European Study Group on Cytogenetic Biomarkers and Health. Cancer Res. 2000;60:1619-25.
Heuser VD, Erdtmann B, Kvitko K, Rohr P, da Silva J. Evaluation of genetic damage in Brazilian footwear-workers: Biomarkers of exposure, effect, and susceptibility. Toxicology. 2007;232:235-47. https://doi.org/10.1016/j.tox.2007.01.011
Martino-Roth M, Viegas J, Roth D. Occupational genotoxicity risk evaluation through the comet assay and the micronucleus test. Genet Mol Res. 2003;2:410-7.
Pereira da Silva VH, Gomes de Moura CF, Spadari-Bratfisch RC, Ribeiro DA. Cytogenetic biomonitoring of peripheral blood and oral mucosa cells from car painters. Toxicol Mech Methods. 2012;22:497-501. https://doi.org/10.3109/15376516.2012.680621
Algunos artículos similares:
- Omayda Cárdenas, Elizabeth Silva, Jaime Eduardo Ortiz, Uso de plaguicidas inhibidores de acetilcolinesterasa en once entidades territoriales de salud en Colombia, 2002-2005 , Biomédica: Vol. 30 Núm. 1 (2010)
- Claudia Milena Monroy, Andrea Carolina Cortés, Diana Mercedes Sicard, Helena Groot de Restrepo, Citotoxicidad y genotoxicidad en células humanas expuestas in vitro a glifosato. , Biomédica: Vol. 25 Núm. 3 (2005)
- Clelia Rosa Calao, José Luis Marrugo, Efectos genotóxicos asociados a metales pesados en una población humana de la región de La Mojana, Colombia, 2013 , Biomédica: Vol. 35 (2015): Agosto, Suplemento 2, Salud y contaminantes ambientales
- Marien Palma, Leonardo Briceño, Álvaro J. Idrovo, Marcela Varona, Evaluación de la exposición a solventes orgánicos en pintores de carros de la ciudad de Bogotá , Biomédica: Vol. 35 (2015): Agosto, Suplemento 2, Salud y contaminantes ambientales
- Claudia Viviana Barbosa, Carlos Enrique Muskus, Luz Yaneth Orozco, Adriana Pabón, Efecto mutagénico y genotóxico, y expresión de los genes Rad51C, Xiap, P53 y Nrf2 inducidos por extractos antipalúdicos de plantas recolectadas en el Vaupés medio, Colombia , Biomédica: Vol. 37 Núm. 3 (2017)
| Estadísticas de artículo | |
|---|---|
| Vistas de resúmenes | |
| Vistas de PDF | |
| Descargas de PDF | |
| Vistas de HTML | |
| Otras vistas | |

























