Los resultados adversos en el tratamiento de la tuberculosis resistente a múltiples fármacos sobrepasan la relación fármaco-microorganismo: resultados de un análisis de correspondencia múltiple
Resumen
Introducción. El tratamiento de la tuberculosis multirresistente tiene una efectividad del 50 %, afectado por múltiples factores como la sensibilidad del microorganismo, las reacciones secundarias, los factores sociales y las comorbilidades existentes.
Objetivos. Describir la demografía, las características clínicas y los factores pronósticos asociados con los resultados del tratamiento en pacientes multirresistentes (TB-MDR) de Medellín, Colombia.
Métodos. Se hizo un análisis retrospectivo de los datos de los pacientes con TB-MDR atendidos en el Hospital La María de Medellín, Colombia, que fueron tratados entre el 2010 y el 2015. Los pacientes se categorizaron con tratamiento exitoso (curados) o con tratamiento fallido (falla en el tratamiento, pérdida durante el seguimiento y muerte). Se determinó la asociación entre las características demográficas y clínicas, los resultados de los exámenes de laboratorio, los desenlaces del tratamiento y la información del seguimiento, utilizando análisis univariado, multivariado y de correspondencia múltiple.
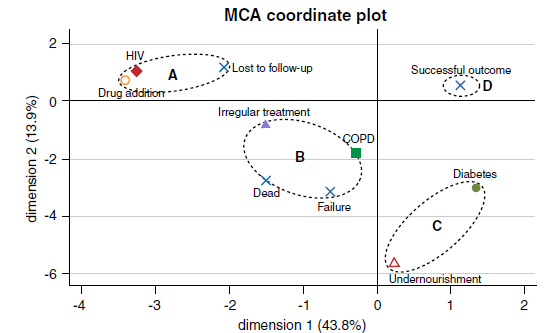
Resultados. De 128 pacientes con TB-MDR, 77 (60 %) tuvieron un tratamiento exitoso. De los que tuvieron un tratamiento fallido, 26 pacientes se perdieron en el seguimiento, 15 murieron y 10 tuvieron falla en el tratamiento. El tratamiento irregular, las comorbilidades y los cultivos positivos más allá de 2 meses de tratamiento se asociaron significativamente con los tratamientos fallidos (p<0,05). El análisis de correspondencia múltiple agrupó los pacientes con pérdida en el seguimiento, con HIV y tratamientos irregulares, y los pacientes con tratamientos irregulares y enfermedad pulmonar obstructiva crónica con falla en el tratamiento y muerte.
Conclusión. El reconocimiento temprano de los factores que afectan el desenlace del tratamiento de los pacientes con TB-MDR es esencial; la identificación de dichos factores debería incrementar el éxito del tratamiento y contribuir al adecuado control de la TB-MDR.
Descargas
Referencias bibliográficas
World Health Organization. Global tuberculosis report – 2012. Accessed on: December 5, 2018. Available at: https://apps.who.int/iris/handle/10665/75938
World Health Organization. Global tuberculosis report – 2017. Accessed on: November 8, 2018. Available at: https://www.who.int/tb/publications/global_report/gtbr2017_main_text.pdf
Lucía M, Martínez O, Enrique M, Durán M, Pacheco-García OE, Bonilla HQ, et al. Protocolo de vigilancia en salud publica tuberculosis – 2016. Accessed on: November 12, 2018. Available at: http://www.saludpereira.gov.co/medios/Tuberculosis_PROTOCOLO_farmacoresistente2016.pdf
Secretaría de Salud y Protección Social de Antioquia. Situación de la tuberculosis en el departamento de Antioquia 2015-2016. Boletín Información para la Acción - 2017. Accessed on: October 5, 2018. Available at: https://www.dssa.gov.co/images/Bia_%20Tuberculosis_Mayo2017.pdf
Gupta R, Cegielski JP, Espinal MA, Henkens M, Kim JY, Lee JW, et al. Increasing transparency in partnerships for health--introducing the Green Light Committee. Trop Med Int Health. 2002;7:970-6. https://doi.org/10.1046/j.1365-3156.2002.00960.x
World Health Organization. Definitions and reporting framework for tuberculosis 2013 revision –2014. Accessed on: July 11, 2018. Available at: https://www.who.int/tb/publications/definitions/en/
Pfyffer GE, Palicova F. Mycobacterium: General characteristics, laboratory detection, and staining procedures. Manual of clinical microbiology, 10th edition. Washington, D.C.: American Society of Microbiology; 2011. p. 472-502.
Robledo J, Mejía GI, Paniagua L, Martín A, Guzmán A. Rapid detection of rifampicin and isoniazid resistance in Mycobacterium tuberculosis by the direct thin-layer agar method. Int J Tuberc Lung Dis. 2008;12:1482-4.
Rodrigues C, Jani J, Shenai S, Thakkar P, Siddiqi S, Mehta A. Drug susceptibility testing of Mycobacterium tuberculosis against second-line drugs using the Bactec MGIT 960 System. Int J Tuberc Lung Dis. 2008;12:1449-55.
Clinical and Laboratory Standards Institute. M24-A2 Susceptibility testing of Mycobacteria, Nocardiae, and other aerobic actinomycetes. 2nd edition. Wayne (PA): Clinical and Laboratory Standards Institute; 2011.
Rusch-Gerdes S, Pfyffer GE, Casal M, Chadwick M, Siddiqi S. Multicenter laboratory validation of the BACTEC MGIT 960 technique for testing susceptibilities of Mycobacterium tuberculosis to classical second-line drugs and newer antimicrobials. J Clin Microbiol. 2006;44:688–92. https://doi.org/10.1128/JCM.44.3.688-692.2006
Instituto Nacional de Salud. Lineamientos para el manejo programático de los pacientes con tuberculosis farmacorresistente – 2013. Accessed on: July 15, 2018. Available at: https://www.minsalud.gov.co/sites/rid/Lists/BibliotecaDigital/RIDE/VS/PP/ET/lineamientos-tbfarmacorresistente.pdf
Johnston JC, Shahidi NC, Sadatsafavi M, Fitzgerald JM. Treatment outcomes of multidrugresistant tuberculosis: A systematic review and meta-analysis. PLoS One. 2009;4:e6914. https://doi.org/10.1371/journal.pone.0006914
Bolhuis MS, Akkerman OW, Sturkenboom MG, de Lange WC, van der Werf TS, Alffenaar J-WC. Individualized treatment of multidrug-resistant tuberculosis using therapeutic drug monitoring. Int J Mycobacteriol. 2016;5:S44-5. https://doi.org/10.1016/j.ijmyco.2016.07.003
Fox MP, Rosen S. Patient retention in antiretroviral therapy programs up to three years on treatment in sub-Saharan Africa, 2007-2009: Systematic review. Trop Med Int Health. 2010;15:1-15. https://doi.org/10.1111/j.1365-3156.2010.02508.x
Kuchukhidze G, Kumar AM, de Colombani P, Khogali M, Nanava U, Blumberg HM, et al. Risk factors associated with loss to follow-up among multidrug-resistant tuberculosis patients in Georgia. Public Health Action. 2014;4:S41-6. https://doi.org/10.5588/pha.14.0048
Surya PI, Davies FL, Bruchfeld J, Hak E, Alffenaar J-W. Risk factors of multidrug-resistant tuberculosis: A global systematic review and meta-analysis. J Infect. 2018;77:469-78. https://doi.org/10.1016/j.jinf.2018.10.004
Dheda K, Shean K, Zumla A, Badri M, Streicher EM, Page-Shipp L, et al. Early treatment outcomes and HIV status of patients with extensively drug-resistant tuberculosis in South Africa: A retrospective cohort study. Lancet. 2010;375:1798-807. https://doi.org/10.1016/S0140-6736(10)60492-8
Tang S, Tan S, Yao L, Li F, Li L, Guo X, et al. Risk factors for poor treatment outcomes in patients with MDR-TB and XDR-TB in China: Retrospective multi-center investigation. PLoS One. 2013;8:e82943. https://doi.org/10.1371/journal.pone.0082943
Caminero JA. Treatment of multidrug-resistant tuberculosis: Evidence and controversies. Int J Tuberc Lung Dis. 2006;10:829-37.
Marrone MT, Venkataramanan V, Goodman M, Hill AC, Jereb JA, Mase SR. Surgical interventions for drug-resistant tuberculosis: A systematic review and meta-analysis. Int J Tuberc Lung Dis. 2013;17:6-16.
Jain K, Desai M, Solanki R, Dikshit RK. Treatment outcome of standardized regimen in patients with multidrug-resistant tuberculosis. J Pharmacol Pharmacother. 2014;5:145-9. https://doi.org/10.4103/0976-500X.130062
Kurbatova EV, Cegielski JP, Lienhardt C, Akksilp R, Bayona J, Becerra MC, et al. Sputum culture conversion as a prognostic marker for end-of-treatment outcome in patients with multidrug-resistant tuberculosis: A secondary analysis of data from two observational cohort studies. Lancet Respir Med. 2015;3:201-9. https://doi.org/10.1016/S2213-2600(15)00036-3
World Health Organization. The shorter MDR-TB regimen – 2016. Accessed on: December 3, 2018. Available at: https://www.who.int/tb/Short_MDR_regimen_factsheet.pdf
Waitt CJ, Squire SB. A systematic review of risk factors for death in adults during and after tuberculosis treatment. Int J Tuberc Lung Dis. 2011;15:871-85. https://doi.org/10.5588/ijtld.10.0352
Whitfield MG, Soeters HM, Warren RM, York T, Sampson SL, Streicher EM, et al. A global perspective on pyrazinamide resistance: Systematic review and meta-analysis. PLoS One. 2015;10:e0133869. https://doi.org/10.1371/journal.pone.0133869
Ghafoor T, Ikram A, Abbasi SA, Zaman G, Ayyub M, Palomino JC, et al. Sensitivity pattern of second line anti-tuberculosis drugs against clinical isolates of multidrug-resistant Mycobacterium tuberculosis. J Coll Physicians Surg Pak. 2015;25:250-3.
Simpson G, Coulter C, Weston J, Knight T, Carter R, Vincent S, et al. Resistance patterns of multidrug-resistant tuberculosis in Western Province, Papua New Guinea. Int J Tuberc Lung Dis. 2011;15:551–2. https://doi.org/10.5588/ijtld.10.0347
Rueda J, Realpe T, Mejía GI, Zapata E, Rozo JC, Ferro BE, et al. Genotypic analysis of genes associated with independent resistance and cross-resistance to isoniazid and ethionamide in Mycobacterium tuberculosis clinical isolates. Antimicrob Agents Chemother. 2015;59:7805-10. https://doi.org/10.1128/AAC.01028-15
Pietersen E, Ignatius E, Streicher EM, Mastrapa B, Padanilam X, Pooran A, et al. Long-term outcomes of patients with extensively drug-resistant tuberculosis in South Africa: A cohort study. Lancet. 2014;383:1230-9. https://doi.org/10.1016/S0140-6736(13)62675-6
| Estadísticas de artículo | |
|---|---|
| Vistas de resúmenes | |
| Vistas de PDF | |
| Descargas de PDF | |
| Vistas de HTML | |
| Otras vistas | |

























