Metaciclogénesis de Trypanosoma cruzi en Belminus ferroae (Reduviidae: Triatominae) y capacidad infectiva de las heces en condiciones de laboratorio
Resumen
Introducción. Belminus ferroae es un triatomino de comportamiento entomófago, sin embargo, puede alimentarse de vertebrados ocasionalmente. No se ha demostrado infección natural por Trypanosoma cruzi en esta especie, como tampoco la metaciclogénesis del parásito.
Objetivo. Examinar la metaciclogénesis de T. cruzi en B. ferroae y la capacidad infectiva de las heces o sus contenidos intestinales en roedores.
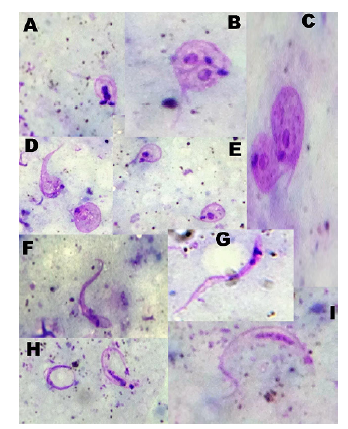
Materiales y métodos. Se analizaron las heces y la orina expulsadas espontáneamente por los insectos o mediante compresión abdominal o extracción del contenido intestinal a los 10, 20, 30, 40, 50 y 60 días. Se cuantificó la carga parasitaria de T. cruzi y sus formas evolutivas se identificaron con tinción de Giemsa. Asimismo, se evaluó en ratones albinos la apacidad infectiva de los tripomastigotes metacíclicos de T. cruzi obtenidos de las heces o contenidos intestinales de los especímenes infectados.
Resultados. El análisis parasitológico reveló tres (15 %) insectos infectados con T. cruzi a los 30 (n=1), 40 (n=1) y 50 (n=1) días después de la infección con cargas parasitarias de hasta 1,62 x 105 tripanosomas/mm3 y porcentajes de metaciclogénesis entre el 3,5 y el 6,78 %.
Conclusiones. Se demuestra por primera vez, en una especie del género Belminus, la metaciclogenésis de T. cruzi en condiciones de laboratorio y la capacidad infectiva de las heces para un huésped vertebrado.
Descargas
Referencias bibliográficas
Otálora-Luna F, Pérez-Sánchez AJ, Sandoval C, Aldana E. Evolution of hematophagous habit in Triatominae (Heteroptera: Reduviidae). Rev Chil Hist Nat. 2015;88:1-13. https://doi.org/10.1186/S40693-014-0032-0
Stanaway JD, Roth G. The burden of chagas disease estimates and challenges. Glob Heart. 2015;10:139-44. https://doi.org/10.1016/j.gheart.2015.06.001
Lent H, Wygodzinsky P. Revision of the Triatominae (Hemiptera, Reduviidae), and their significance as vectors of Chagas disease. Bull Am museum Nat Hist. 1979;163:123-520.
Schofield CJ, Galvão C. Classification, evolution, and species groups within the Triatominae. Acta Trop. 2009;110:88-100. https://doi.org/10.1016/j.actatropica.2009.01.010
Sandoval CM, Joya MI, Gutiérrez R, Angulo VM. Cleptohaematophagy of the Triatomine bug Belminus herreri. Med Vet Entomol. 2000;14:100-1. https://doi.org/10.1046/j.1365-2915.2000.00210
Sandoval CM, Medone P, Nieves EE, Jaimes DA, Ortiz N, Rabinovich JE. Demographic fitness of Belminus ferroae (Hemiptera: Triatominae) on three different hosts under laboratory conditions. Mem Inst Oswaldo Cruz. 2013;108:854-64. https://doi.org/10.1590/0074-0276130211
Díaz-Albiter HM, Ferreira TN, Costa SG, Rivas GB, Gumiel M, Cavalcante DR, et al. Everybody loves sugar: First report of plant feeding in triatomines. Parasit Vectors. 2016;9. https://doi.org/10.1186/s13071-016-1401-0
Durán P, Siñani E, Depickère S. On triatomines, cockroaches and haemolymphagy under laboratory conditions: New discoveries. Mem Inst Oswaldo Cruz. 2016;111:605-13. https://doi.org/10.1590/0074-02760160027
Schmidt JO, Dorn PL, Klotz SA. Second-best is better than nothing: Cockroaches as a viable food source for the kissing bug Triatoma recurva (Hemiptera: Reduviidae). J Med Entomol. 2019;56:651-5. https://doi.org/10.1093/jme/tjy233
Sandoval CM, Duarte R, Gutiérrez R, Da Silva Rocha D, Angulo VM, Esteban L, et al. Feeding sources and natural infection of Belminus herreri (Hemiptera, Reduviidae, Triatominae) from dwellings in Cesar, Colombia. Mem Inst Oswaldo Cruz. 2004;99:137-40. https://doi.org/10.1590/S0074-02762004000200004
Sandoval CM, Ortiz N, Jaimes D, Lorosa E, Galvão C, Rodríguez O, et al. Feeding behaviour of Belminus ferroae (Hemiptera: Reduviidae), a predaceous Triatominae colonizing rural houses in Norte de Santander, Colombia. Med Vet Entomol. 2010;24:124-31. https://doi.org/10.1111/j.1365-2915.2010.00868.x
Sandoval CM, Nieves EE, Gutiérrez R, Jaimes DA, Rodríguez NO, Otálora-Luna F, et al. Morphometric analysis of the host effect on phenotypical variation of Belminus ferroae (Hemiptera: Triatominae). Psyche. 2015;2015. https://doi.org/10.1155/2015/613614
Gil-Santana H. Estudo taxonômico da tribo Bolboderini (Hemiptera-Heteroptera, Reduviidae, Triatominae), com análise cladística. Rio de Janeiro: Instituto Oswaldo Cruz; 2014. Fecha de consulta: 21 de mayo de 2020. Disponible en: https://www.arca.fiocruz.br/handle/icict/12124
Galvão C, Angulo VM. Belminus corredori, a new species of Bolboderini (Hemiptera: Reduviidae: Triatominae) from Santander, Colombia. Zootaxa. 2006;1241:61-8. https://doi.org/10.11646/zootaxa.1241.1.4
Sandoval CM. Aspectos biológicos y morfológicos de Belminus sp. de Norte de Santander, Colombia. Mérida: Universidad de Los Andes; 2007.
Alarcón M, Pérez MC, Villarreal J, Araújo S, Goncalves L, González A, et al. Detección de ADN de Trypanosoma cruzi en la placenta y fetos de ratones con infección chagásica aguda. Invest Clin. 2009;50:335-45.
Yarbuh AL, Cáceres K, Sulbarán D, Araujo S, Moreno E, Carrasco HJ, et al. Proliferación de Trypanosoma cruzi en la membrana peritoneal y líquido ascítico de ratones con infección aguda. Bol Malariol y Salud Ambient. 2013;53:146-56.
Brenner Z. Observações sobre a inmunidade a superinfecções em camundongos experimentalmente inoculados com Trypanosoma cruzi e submetidos a tratamento. Rev Inst Med Trop São Paulo.1962;4:119-23.
Perlowagora-Szumlewicz A, Moreira CJ. In vivo differentiation of Trypanosoma cruzi-1. Experimental evidence of the influence of vector species on metacyclogenesis. Mem Inst Oswaldo Cruz. 1994;89:603-18. https://doi.org/10.1590/s0074-02761994000400018
Suárez-Quevedo Y, Barbosa-Vinasco HM, Gutiérrez-Garnizo SA, Olaya-Morales JL, Zabala-González D, Carranza-Martínez JL, et al. Innate trypanolytic factors in triatomine hemolymph against Trypanosoma rangeli and T. cruzi: A comparative study in eight Chagas disease vectors. Rev Acad Colomb Cienc Ex Fis Nat. 2020;44:88-104. https://doi.org/10.18257/raccefyn.1097
Basseri HR, Dadi-Khoeni A, Bakhtiari R, Abolhassani M, Hajihosseini-Baghdadabadi R. Isolation and purification of an antibacterial protein from immune induced haemolymph of American Cockroach, Periplaneta americana. J Arthropod Borne Dis. 2016;10:519-27.
Algunos artículos similares:
- Cielo León, Mario Iván Ortiz, Catalina Tovar, Jorge Negrete, Ernesto Arroyo, Camila González, Detección y caracterización molecular de cepas de Trypanosoma cruzi aisladas de triatominos recolectados por la comunidad en el departamento de Córdoba, Colombia , Biomédica: Vol. 39 Núm. 2 (2019)
- Omar Cantillo-Barraza, Andrés Gómez-Palacio, Diego Salazar, Ana María Mejía-Jaramillo, Jaime Calle, Omar Triana, Distribución geográfica y ecoepidemiología de la fauna de triatominos (Reduviidae: Triatominae) en la Isla Margarita del departamento de Bolívar, Colombia , Biomédica: Vol. 30 Núm. 3 (2010)
- Lizbeth Díaz, Karen Covarrubias, Ángel Licón, Mixtli Astorga, Yaneth Moreno, José Alejandro Martínez, Parámetros biológicos de Meccus phyllosomus phyllosomus (Burmeister) 1835, de Triatoma recurva (Stål) 1868 (Hemiptera, Reduviidae) y de sus híbridos de laboratorio , Biomédica: Vol. 37 Núm. Sup. 2 (2017): Suplemento 2, Entomología médica, 2017
- Víctor Manuel Angulo, Lyda Esteban, Katherine Paola Luna, Attalea butyracea próximas a las viviendas como posible fuente de infestación domiciliaria por Rhodnius prolixus (Hemiptera: Reduviidae) en los Llanos Orientales de Colombia , Biomédica: Vol. 32 Núm. 2 (2012)
- María Clara Echeverry, Nubia Catalina Tovar, Guillermo Mora, Presencia de anticuerpos contra neurorreceptores cardiacos de acetilcolina muscarínicos tipo II en pacientes con enfermedad de Chagas e implantación de marcapasos , Biomédica: Vol. 29 Núm. 3 (2009)
- Marlene Reyes, Víctor Manuel Angulo, Ciclo de vida de Triatoma dimidiata Latreille, 1811 (Hemiptera, Reduviidae) en condiciones de laboratorio: producción de ninfas para ensayos biológicos , Biomédica: Vol. 29 Núm. 1 (2009)
- Dairo Alonso Rendón, Carlos M. Genes, Omar Triana, Lesión celular del miocardio y actividad de la ATPsintasa mitocondrial en ratas infectadas con una cepa colombiana de Trypanosoma cruzi , Biomédica: Vol. 27 Núm. 1esp (2007): Enfermedad de Chagas
- Sandra Paola Santander, Adriana Cuéllar, María del Carmen Thomas, Fanny Guzmán, Alberto Gómez, Manuel Carlos López, Concepción Puerta, Expresión de marcadores en células dendríticas de pacientes chagásicos crónicos estimuladas con la proteína KMP-11 y el péptido K1 de Trypanosoma cruzi , Biomédica: Vol. 27 Núm. 1esp (2007): Enfermedad de Chagas
- José Alejandro Martínez-Ibarra, Jorge Alejandro Martínez-Grant, Miguel Roberto Verdugo-Cervantes, Rafael Bustos-Saldaña, Benjamín Nogueda-Torres, Vigilancia de la presencia de triatominos mediante gallineros en el sur de Jalisco, México , Biomédica: Vol. 30 Núm. 1 (2010)
- Nelson Grisales, Omar Triana, Víctor Angulo, Nicolás Jaramillo, Gabriel Parra-Henao, Francisco Panzera, Andrés Gómez-Palacio, Diferenciación genética de tres poblaciones colombianas de Triatoma dimidiata (Latreille, 1811) mediante análisis molecular del gen mitocondrial ND4 , Biomédica: Vol. 30 Núm. 2 (2010)
| Estadísticas de artículo | |
|---|---|
| Vistas de resúmenes | |
| Vistas de PDF | |
| Descargas de PDF | |
| Vistas de HTML | |
| Otras vistas | |

























