Identificación molecular de Entamoeba histolytica, Entamoeba dispar y Entamoeba moshkovskii en niños con diarrea en Maracaibo, Venezuela
Resumen
Introducción. Las amebas no patógenas Entamoeba dispar, Entamoeba moshkovskii y Entamoeba bangladeshi son morfológicamente idénticas a Entamoeba histolytica, parásito responsable de la amebiasis, por lo cual se necesitan técnicas moleculares para diferenciarlas.
Objetivo. Determinar la frecuencia de las diferentes especies de Entamoeba mediante reacción en cadena de la polimerasa (Polymerase Chain Reaction, PCR) en muestras fecales de niños menores de cinco años con diarrea, provenientes de Maracaibo (Venezuela).
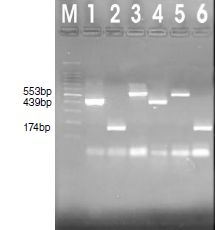
Materiales y métodos. Se recolectó una muestra fecal por individuo en 75 niños con diarrea (grupo de casos) y en 25 niños sin diarrea (grupo control). Las heces se evaluaron mediante examen microscópico, método de concentración de formól-éter y PCR múltiple anidada en una sola ronda para identificar E. histolytica, E. dispar y E. moshkovskii. Además, se hizo una encuesta en la que se recopilaron los datos demográficos, signos, manifestaciones clínicas y estrato socioeconómico de los niños.
Resultados. El 48 % de los participantes (38 del grupo de casos y 10 del grupo de control) tenían enteroparásitos. Solo en las muestras de cuatro de los niños, se encontraron quistes del complejo Entamoeba (tres en el grupo de casos y uno en el de control). Mediante PCR se amplificaron nueve muestras (9 %) para la detección de las amebas estudiadas. En el grupo de casos se registraron tres (28,13 %) de E. histolytica, cuatro (30,50 %) de E. dispar y una (9,37 %) de E. moshkovskii, en tanto que solo una (25 %) muestra amplificó para E. dispar en el grupo de control.
Conclusión. En general, predominó E. dispar; sin embargo, todos los infectados con E. histolytica se detectaron en el grupo de niños con diarrea y se detectó el primer caso de E. moshkovskii en la región.
Descargas
Referencias bibliográficas
Ríos-Uil J, Mercadillo-Pérez P, Yuil de Ríos E, Ríos-Castro M. Amebiasis cutánea. Conceptos actuales. Rev Med Hosp Gen Mex. 2012;75:114-22.
Cui Z, Li J, Chen Y, Zhang L. Molecular epidemiology, evolution, and phylogeny of Entamoeba spp. Infec Genet Evol. 2019;75:104018 https://doi.org/10.1016/j.meegid.2019.104018
Carrero J, Reyes-López M, Serrano-Luna J, Shibayama M, Unzueta J, León-Sicairos N, et al. Intestinal amoebiasis: 160 years of its first detection and still remains as a health problem in developing countries. Int J Med Microbiol. 2020;310:151358. https://doi.org/10.1016/j.ijmm.2019.151358
Ngobeni R, Samie A, Moonah S, Watanabe K, Petri WA, Gilchrist C. Entamoeba species in South Africa: Correlations with the host microbiome, parasite burdens, and first description of Entamoeba bangladeshi outside of Asia. J Infect Dis. 2017;216:1592-600. https://doi.org/10.1093/infdis/jix535
Foda AA, El-Malky MM. Prevalence of genital tract infection with Entamoeba gingivalis among copper T 380A intrauterine device users in Egypt. Contraception 2012;85:108-12. https://doi.org/10.1016/j.contraception.2011.04.006
Levecke B, Dorny P, Vercammen F, Visser LG, van Esbroeck M, Vercruysse J, et al. Transmission of Entamoeba nuttalli and Trichuris trichiura from nonhuman primates to humans. Emerg Infect Dis. 2015;21:1871-2. https://doi.org/10.3201/eid2110.141456
Botero D, Restrepo M. Parasitosis humanas. 4ta edición. Medellín: Ediciones Corporación para Investigaciones Biológicas; 2012. p. 725.
Najafia A, Mirzaeia A, Kermanjania A, Abdia J, Ghaderic A, Naserifara R. Molecular identification of Entamoeba histolytica from stool samples of Ilam, Iran. Comp Immunol Microbiol Infect Dis. 2019;63:145-7. https://doi.org/10.1016/j.cimid.2019.01.003
Rivero de Rodríguez Z. Detección de Entamoeba moshkovskii en humanos: un nuevo problema diagnóstico en la amebiasis. Kasmera. 2013;41:42-9.
Gilchrist CA. Entamoeba bangladeshi: An insight. Trop Parasitol. 2014;4:96-8. https://doi.org/10.4103/2229-5070.138536
Quintero R. Crecimiento y desarrollo psicológico al niño venezolano. Puericultura Atención Primaria en Salud infanto-juvenil. Maracaibo: Ediciones Psicopediátricas; 2001. p. 7-10.
Méndez H, De Méndez MC. Sociedad y Estratificación: Método Graffar-Méndez Castellano. Caracas: Editor Fundacredesa; 1994. p. 206.
Melvin D, Brooke M. Métodos de laboratorios para el diagnóstico de parasitosis intestinales. México: Editorial Interamericano; 1971. p. 198.
Rivero Z, Bracho A, Calchi M, Díaz I, Acurero E, Maldonado A, et al. Detección y diferenciación de Entamoeba histolytica y Entamoeba dispar mediante reacción en cadena de la polimerasa en individuos de una comunidad del Estado Zulia, Venezuela. Cad Saúde Pública. 2009;25:151-9. https://doi.org/10.1590/S0102-311X2009000100016
Khairnar K, Parija S. A novel nested multiplex polymerase Chain Reaction (PCR). Assay for differential detection of E. histolytica, E. dispar and moshkovskii DNA in stool samples. BMC Microbiol. 2007;7:47. https://doi.org/10.1186/1471-2180-7-47
Ngui R, Angal L, Fakhrurrazi S, Ai Lian Y, Ling L, Ibrahim J, et al. Differentiating Entamoeba histolytica, Entamoeba dispar and Entamoeba moshkovskii using nested polymerase chain reaction (PCR) in rural communities in Malaysia. Parasit Vectors. 2012;5:187. https://doi.org/10.1186/1756-3305-5-187
Wayne D. Bioestadística. Base para el análisis de las ciencias de la salud. Cuarta edición. México, D.F.: Limusa Wiley; 2002. p. 665.
Bracho A, Rivero de Rodríguez Z, Arraiz N, Villalobos R, Urdaneta H. Detección de Entamoeba histolytica y Entamoeba dispar mediante PCR, en niños menores de cinco años con diarrea, en Maracaibo, Venezuela: estudio preliminar. Invest Clin. 2013;54:373-81.
Samie A, Mahlaule L, Mbati P, Nozaki T, ElBakri A. Prevalence and distribution of Entamoeba species in a rural community in northern South Africa. Food Waterborne Parasitol. 2020;18:e00076. https://doi.org/10.1016/j.fawpar.2020.e00076
Sharbatkhori M, Nazemalhosseini-Mojarad E, Cheraghali F, Maghsoodloorad FS, Taherkhani H, Vakili MA. Discrimination of Entamoeba spp. in children with dysentery. Gastroenterol Hepatol Bed Bench. 2014;7:164-7.
López O, López M, Corredor V, Echeverri C, Pinilla A. Differentiation of Entamoeba histolytica from Entamoeba dispar using Gal/GalNAc-lectin and polymerase chain reaction. Rev Med Chile. 2012;140:476-83. https://doi.org/10.4067/S0034-98872012000400008
Calegar DA, Nunes BC, Monteiro KJ, Santos JP, Toma HK, Gomes TF, et al. Frequency and molecular characterisation of Entamoeba histolytica, Entamoeba dispar, Entamoeba moshkovskii, and Entamoeba hartmanni in the context of water scarcity in northeastern Brazil. Mem Inst Oswaldo Cruz. 2016;111:114-9. https://doi.org/10.1590/0074-02760150383
Abid T. Molecular identification of some species of Entamoeba isolated from patients with diarrhea in Afak city/Qadisiyah governorate using real-time PCR technique. Int J Recent Sci Res. 2016;7:11207-11.
Bahrami F, Haghighi A, Zamini G, Khademerfan M. Differential detection of Entamoeba histolytica, Entamoeba dispar and Entamoeba moshkovskii in faecal samples using nested multiplex PCR in west of Iran. Epidemiol Infect. 2019;147:E96. https://doi.org/10.1017/S0950268819000141
Saidin S, Abu Bakar A, Mohd Zain BM. Prevalence and associated risk factors of Entamoeba histolytica, E. dispar and E. moshkovskii infection among Orang Asli communities in Slim River, Perak. JSML. 2020;8:22-35.
Mora L, García A, De Donato M, Urdaneta H. Estudio epidemiológico y molecular de cepas de Entamoeba histolytica y Entamoeba dispar en pacientes con diarrea en Cumaná, estado Sucre, Venezuela. Invest Clin. 2008;49:225-37.
Roshdy MH, Abd El-Kader NM, Ali-Tammam M, Fuentes I, Mohamed MM, El-Sheikhand NA, et al. Molecular diagnosis of Entamoeba spp. versus microscopy in the Great Cairo. Acta Parasitol. 2017;62:188-91. https://doi.org/10.1515/ap-2017-0022
Haque R, Ali I, Clark C, Petri W. A case report of Entamoeba moshkovskii infection in a Bangladesh child. Parasitol Inter.1998;47:201-2.
Ali IKM, Hossain MB, Roy S, Ayeh-Kumi PF, Petri Jr W, Haque R, et al. Entamoeba moshkovskii infections in children, Bangladesh. Emerg Infect Dis. 2003;9:580-4. https://doi.org/10.3201/eid0905.020548
Levecke B, Dreesen L, Barrionuevo-Samaniego M, Ortiz WB, Praet N, Brandt J, et al. Molecular differentiation of Entamoeba spp. in a rural community of Loja province, South Ecuador. Trans R Soc Trop Med Hyg. 2011;105:737-9. https://doi.org/10.1016/j.trstmh.2011.08.010
Bachkanji AB. Identificación molecular de especies de Entamoeba en muestras fecales provenientes de pacientes del anexo pediátrico del “Hospital Luis Razetti” de Barcelona, Estado Anzoátegui y su relación con síntomas clínicos. (disertación). Anzoátegui: Universidad de Oriente; 2011.
López M, León C, Fonseca J, Reyes P, Moncada L, Olivera M, et al. Molecular epidemiology of Entamoeba: First description of Entamoeba moshkovskii in a rural area from central Colombia. PLoS ONE. 2015;14:1-11 https://doi.org/10.1371/journal.pone.0140302
Soares NM, Azevedo HC, Pacheco FTF, De Souza JN, Del-Rei RP, Teixeira MCA, et al. A cross-sectional study of Entamoeba histolytica/dispar/moshkovskii complex in Salvador, Bahia, Brazil. Biomed Res Int. 2019;2019:7523670. https://doi.org/10.1155/2019/7523670
Ngui R, Hassan N, Soffyan N, Mohd-Shaharuddin N, Chang Li Y, Shuan C, et al. Copromolecular study of Entamoeba infection among the indigenous community in Malaysia: A first report on the species-specific prevalence of Entamoeba in dogs, Acta Tropica. 2020;204:105334. https://doi.org/10.1016/j.actatropica.2020.105334
Castro AA, Bacalhau F, Silva FF, Avillez C, Batalheiro J. Entamoeba histolytica como causa de diarreia crônica. Rev Bras Med Fam Comunidade. 2019;14:1917. https://doi.org/10.5712/rbmfc14(41)1917
Aguilar-Solís BE, Sánchez-Rodríguez A, Sael-Lima M, Álvarez-Trejo VE. Amebiasis vulvar. Dermatol Rev Mex. 2017;61:142-6.
Blessmann J, Ali IK, Nu PA, Dinh BT, Viet TQ, Van AL, et al. Longitudinal study of intestinal Entamoeba histolytica infections in asymptomatic adult carriers. J Clin Microbiol. 2003;41:4745-50. https://doi.org/10.1128/jcm.41.10.4745-4750.2003
Andrade A, Santana T. Entamoeba histolytica como causa da amebíase. Rev Saúde Meio Ambiente. 2020;10:133-9
Aguilar-Rojas A, Castellanos-Castro S, Matondo M, Giai Q, Varet H, Sismeiro O, et al. Insights into amebiasis using a human 3D-intestinal model. Cell Microbiol. 2020;22:e13203. https://doi.org/10.1111/cmi.13203
Hernández C, Moreno J, Olarte M, Meza E, Regalado J. Amebiasis intestinal: infección que prevalece. Ibn Sina. 2020;11:1-11.
Saavedra E, Olivos A. Amebiasis. Ciencia. 2017;68:14-7.
Ugboko HU, Nwinyi OC, Oranusi SU, Oyewal JO. Childhood diarrhoeal diseases in developing countries. Heliyon. 2020;6:e03690 https://doi.org/10.1016/j.heliyon.2020.e03690
Haque R, Mondai D, Kirkpatrick B, Akter S, Farr B, Sack B, et al. Epidemiologic and clinical characteristics of acute diarrhea with emphasis on Entamoeba histolytica infections in preschool children in an urban slum of Dhaka, Bangladesh. Am J Trop Med Hyg. 2003;69:398-405.
Akisu C, Aksoy U, Cetin H, Ustun S, Akisu M. Effect of human milk and colostrum on Entamoeba histolytica. World J Gastroenterol. 2004;10:741-2. https://doi.org/10.3748/wjg.v10.i5.741
Devera R, Aguilar K, Maurera R, Blanco Y, Amaya I, Velásquez V. Parasitosis intestinales en alumnos de la escuela básica nacional: “San José de Cacahual”. San Félix, Estado Bolívar, Venezuela. Rev Academia. 2016;15:35-46.
Cociancica P, Torrusio S, Zonta ML, Navone G. Risk factors for intestinal parasitoses among children and youth of Buenos Aires, Argentina. One Health. 2020;9:100116. https://doi.org/10.1016/j.onehlt.2019.100116
Gholipoor Z, Khazan H, Azargashb E, Youssefi M, Rostami A. Prevalence and risk factors of intestinal parasite infections in Mazandaran province, North of Iran. Clin Epidemiol Global Health 2020;8:17-20. https://doi.org/10.1016/j.cegh.2019.03.010
Algunos artículos similares:
- Nelsy Loango, Martha Lucía Gallego, Beatriz Restrepo, Patricia Landázuri, Diferencias de sexo, edad y lípidos plasmáticos asociadas al polimorfismo de la apolipoproteína E en un grupo de escolares de Quindío, Colombia , Biomédica: Vol. 29 Núm. 3 (2009)
- María Fernanda Gutiérrez, Sandra Moreno, Mónica Viviana Alvarado, Andrea Bermúdez, Análisis filogenético de las cepas de rotavirus y virus de la hepatitis A encontradas en agua de consumo en el municipio de Quibdó, Chocó , Biomédica: Vol. 29 Núm. 2 (2009)
- Rosa Magdalena Uscátegui, Adriana M. Correa, Jaime Carmona-Fonseca, Cambios en las concentraciones de retinol, hemoglobina y ferritina en niños palúdicos colombianos , Biomédica: Vol. 29 Núm. 2 (2009)
- Andrés Leonardo González, Ruth Aralí Martínez, Luis Ángel Villar, Evolución clínica de pacientes hospitalizados por dengue en una institución de salud de Bucaramanga, Colombia , Biomédica: Vol. 28 Núm. 4 (2008)
- Elsa Nieves, Néstor Villarreal, Maritza Rondón, Mireya Sánchez, José Carrero, Evaluación de conocimientos y prácticas sobre la leishmaniasis tegumentaria en un área endémica de Venezuela , Biomédica: Vol. 28 Núm. 3 (2008)
- Elpidia Poveda, Diana Giraldo, Yibby Forero, Carlos Mendivil, Actividad física autorreportada, comparación con indicadores antropométricos de grasa corporal en un grupo de escolares de Bogotá y de cinco departamentos del centro-oriente, Colombia 2000-2002 , Biomédica: Vol. 28 Núm. 3 (2008)
- Elsa Villarreal, Yibby Forero, Elpidia Poveda, César Baracaldo, Elizabeth López, Marcadores de riesgo cardiovascular en escolares de cinco departamentos de la región oriental en Colombia , Biomédica: Vol. 28 Núm. 1 (2008)
- Olga Serrano, Florencio Mendoza, Benny Suárez, Ana Soto, Seroepidemiología de la enfermedad de Chagas en dos localidades del municipio Costa de Oro, estado Aragua, Venezuela , Biomédica: Vol. 28 Núm. 1 (2008)
- Elpidia Poveda, Ney E. Callas, César M. Baracaldo, Carlina Castillo, Patricia Hernández, Concentración sérica de leptina en población escolar de cinco departamentos del centro-oriente colombiano y su relación con parámetros antropométricos y perfil lipídico , Biomédica: Vol. 27 Núm. 4 (2007)
- Guillermo Terán-Ángel, Vestalia Rodríguez, Rosilved Silva, Olga Zerpa, Henk Schallig, Marian Ulrich, Maira Cabrera, Herramientas no invasivas en Venezuela: comparación entre las pruebas inmunoserológicas DAT, rK26 y rK39 en el diagnóstico de leishmaniasis visceral , Biomédica: Vol. 30 Núm. 1 (2010)
Datos de los fondos
-
Consejo de Desarrollo Científico, Humanístico y Tecnológico, Universidad del Zulia
Números de la subvención CONDES-0490-13
| Estadísticas de artículo | |
|---|---|
| Vistas de resúmenes | |
| Vistas de PDF | |
| Descargas de PDF | |
| Vistas de HTML | |
| Otras vistas | |

























