Cáncer de mama en seis familias del Tolima y el Huila: mutación BRCA1 3450del4
Resumen
Introducción. El cáncer de mama es un problema mundial de salud pública; entre el 5 y el 10 % de los casos presentan agregación familiar, lo que se explicaría por la presencia de mutaciones en genes de alto riesgo como el BRCA1 y el BRCA2. El origen fundador de la deleción BRCA1 3450del4 en Colombia ya fue reportado.
Objetivo. Hacer un análisis descriptivo de seis familias del del Tolima y del Huila con la deleción BRCA1 3450del4 de la asociación de la mutación germinal, con el cáncer de mama y la agregación familiar.
Materiales y métodos. Se hizo un estudio descriptivo y transversal de seis casos índice con cáncer de mama positivos para BRCA1 3450del4, que cumplían tres de los criterios establecidos por Jalkh, et al. A partir de la información de las entrevistas, se realizaron los árboles genealógicos (GenoPro™, versión 2016). Se tipificó la mutación en familiares sanos y afectados que aceptaron participar.
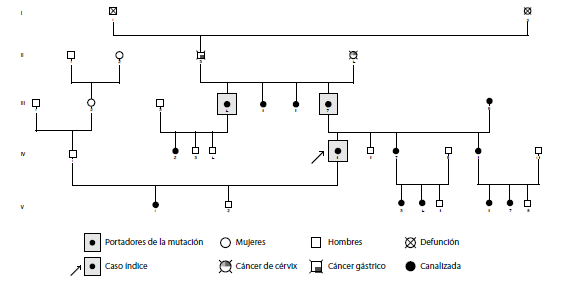
Resultados. De los 78 individuos seleccionados por conveniencia en las seis familias, 30 presentaron la mutación BRCA1 3450del4; de ellos, seis tenían cáncer de mama, uno, cáncer de ovario, uno, cáncer de mama y ovario, y otro, cáncer de próstata; 21 no presentaban neoplasias. De los 30 individuos portadores de la variante patogénica, seis eran hombres y 24 mujeres, 13 de ellas menores de 30 años.
Conclusiones. En este estudio se confirmó la asociación de la deleción BRCA1 3450del4 con el cáncer de mama de agregación familiar.
Descargas
Referencias bibliográficas
International Agency for Research on Cancer. Global Cancer Observatory 2018. Fecha de consulta: 26 de abril de 2019. Disponible en https://gco.iarc.fr/
PDQ Cancer Genetics Editorial Board. Genetics of Breast and Gynecologic Cancers (PDQ®). Bethesda, MD: National Cancer Institute; 2002.
Ashton-Prolla P, Vargas FR. Prevalence and impact of founder mutations in hereditary breast cancer in Latin America. Genet Mol Biol. 2014;37:234-40.
Golubeva VA, Nepomuceno TC, Monteiro AN. Germline missense variants in BRCA1: New trends and challenges for clinical annotation. Cancers (Basel). 2019;11:522-36. https://doi.org/10.3390/cancers11040522
Seong M-W, Im Cho S, Kim KH, Chung IY, Kang E, Lee JW, et al. A multi-institutional study of the prevalence of BRCA1 and BRCA2 large genomic rearrangements in familial breast cancer patients. BMC Cancer. 2014;14:645. https://doi.org/10.1186/1471-2407-14-645
Hahnen E, Lederer B, Hauke J, Loibl S, Kröber S, Schneeweiss A, et al. Germline mutation status, pathological complete response, and disease-free survival in triple-negative breast cancer: Secondary analysis of the GeparSixto Randomized Clinical Trial. JAMA Oncol. 2017;3:1378-85. https://doi.org/10.1001/jamaoncol.2017.1007
Hernández JE, Llacuachaqui M, Palacio GV, Figueroa JD, Madrid J, Lema M, et al. Prevalence of BRCA1 and BRCA2 mutations in unselected breast cancer patients from Medellín, Colombia. Hered Cancer Clin Pract. 2014;12:11. https://doi.org/10.1186/1897-4287-12-11
Kuchenbaecker KB, Hopper JL, Barnes DR, Phillips KA, Mooij TM, Roos-Blom MJ, et al. Risks of breast, ovarian, and contralateral breast cancer for BRCA1 and BRCA2 mutation carriers. JAMA. 2017;317:2402-16. https://doi.org/10.1001/jama.2017.7112
Abdulrashid K, AlHussaini N, Ahmed W, Thalib L. Prevalence of BRCA mutations among hereditary breast and/or ovarian cancer patients in Arab countries: Systematic review and meta-analysis. BMC Cancer. 2019;19:256. https://doi.org/10.1186/s12885-019-5463-1
Jalkh N, Chouery E, Haidar Z, Khater C, Atallah D, Ali H, et al. Next-generation sequencing in familial breast cancer patients from Lebanon. BMC Med Genomics. 2017;10:8. https://doi.org//10.1186/s12920-017-0244-7
Weitzel JN, Lagos V, Blazer KR, Nelson R, Ricker C, Herzog J, et al. Prevalence of BRCA mutations and founder effect in high-risk Hispanic families. Cancer Epidemiol Biomarkers Prev. 2005;14:1666-71. https://doi.org/10.1158/1055-9965.EPI-05-0072
Mahfoudh W, Bouaouina N, Ahmed SB, Gabbouj S, Shan J, Mathew R, et al. Hereditary breast cancer in Middle Eastern and North African (MENA) populations: Identification of novel, recurrent and founder BRCA1 mutations in the Tunisian population. Mol Biol Rep. 2012;39:1037-46. https://doi.org/10.1007/s11033-011-0829-8
Torres DE, Umaña Á Robledo J, Caicedo J, Quintero E, Orozco A, et al. Estudio de factores genéticos para cáncer de mama en Colombia. Universitas Médica. 2009;50:297-301.
Rodríguez AO, Llacuachaqui M, Pardo GG, Royer R, Larson G, Weitzel JN, et al. BRCA1 and BRCA2 mutations among ovarian cancer patients from Colombia. Gynecol Oncol. 2012;124:236-43. https://doi.org/10.1016/j.ygyno.2011.10.027
Ossa CA, Torres D. Founder and recurrent mutations in BRCA1 and BRCa2 genes in Latin American countries: State of the art and literature review. Oncologist. 2016;21:832-9. https://doi.org/10.1634/theoncologist.2015-0416
Ramírez C. Análisis genético del mestizaje y su relación con el carcinoma de glándula mamaria en dos grupos de mujeres del Tolima y Huila (tesis). Ibagué: Universidad del Tolima; 2015.
Fejerman L, Ahmadiyeh N, Hu D, Huntsman S, Beckman KB, Caswell JL, et al. Genomewide association study of breast cancer in Latinas identifies novel protective variants on 6q25. Nat Commun. 2014;5:5260. https://doi.org/10.1038/ncomms6260
Sun YS, Zhao Z, Yang ZN, Xu F, Lu HJ, Zhu ZY, et al. Risk factors and preventions of breast cancer. Int J Biol Sci. 2017;13:1387-97. https://doi.org/10.7150/ijbs.21635
Barnard ME, Boeke CE, Tamimi RM. Established breast cancer risk factors and risk of intrinsic tumor subtypes. Biochim Biophys Acta. 2015;1856:73-85. https://doi.org/10.1016/j.bbcan.2015.06.002
Rojas K, Stuckey A. Breast cancer epidemiology and risk factors. Clin Obstet Gynecol. 2016;59:651-72. https://doi.org/10.1097/GRF.0000000000000239
Singer CF, Tan YY, Muhr D, Rappaport C, Gschwantler-Kaulich D, Grimm C, et al. Association between family history, mutation locations, and prevalence of BRCA1 or 2 mutations in ovarian cancer patients. Cancer Med. 2019;1:1-7. https://doi.org/10.1002/cam4.2000
Han S-A, Kim S-W, Kang E, Park SK, Ahn S-H, Lee MH, et al. The prevalence of BRCA mutations among familial breast cancer patients in Korea: Results of the Korean Hereditary Breast Cancer study. Fam Cancer. 2013;12:75-81. https://doi.org/10.1007/s10689-012-9578-7
Durocher F, Tonin P, Shattuck-Eidens D, Skolnick M, Narod SA, Simard J. Mutation analysis of the BRCA1 gene in 23 families with cases of cancer of the breast, ovary, and multiple other sites. J Med Genet. 1996;33:814-9. https://doi.org/10.1136/jmg.33.10.814
Torres D, Rashid MU, Gil F, Umaña A, Ramelli G, Robledo JF, et al. High proportion of BRCA1/2 founder mutations in Hispanic breast/ovarian cancer families from Colombia. Breast Cancer Res Treat. 2007;103:225-32. https://doi.org/10.1007/s10549-006-9370-1
Briceño I, Gómez A, Días NA, Noguera MC, Díaz D, Casas MC. Espectro de mutaciones en los genes BRCA1 y BRCA2 asociados a cáncer de mama en Colombia. Colombia Médica. 2017;48:58.
Jara L, Ampuero S, Santibáñez E, Seccia L, Rodríguez J, Bustamante M, et al. BRCA1 and BRCA2 mutations in a South American population. Cancer Genet Cytogenet. 2006;166:36-45. https://doi.org/10.1016/j.cancergencyto.2005.08.019
Felix GE, Abe-Sandes C, Machado-Lopes TM, Bomfim TF, Guindalini RS, Santos VC, et al. Germline mutations in BRCA1, BRCA2, CHEK2 and TP53 in patients at high-risk for HBOC: characterizing a Northeast Brazilian Population. Hum Genome Var. 2014;1:14012. https://doi.org/10.1038/hgv.2014.12
Gumaste PV, Penn LA, Cymerman RM, Kirchhoff T, Polsky D, McLellan B. Skin cancer risk in BRCA1/2 mutation carriers. Br J Dermatol. 2015;172:1498-506. https://doi.org/10.1111/bjd.13626
Vélez M, Rosendaal N, Alvarado B, Da Câmara S, Belanger E, Pirkle C. Age at natural menopause and physical function in older women from Albania, Brazil, Colombia and Canada: A life-course perspective. Maturitas. 2019;122:22-30.
Gibson G. A primer of human genetics. Sunderland, USA: Sinauer Associates, Inc.; 2015. p. 335-8.
Gudmundsson GJ, Bergthorsson JT, Arason A, Ingvarsson S, Valgardur E, Barkardottir RB. Different tumor types from BRCA2 carriers show wild-type chromosome deletions on 13Q12-Q131. Cancer Res. 1995;55:4830-2.
Caldés T. Cáncer hereditario: fundamentos genéticos. Psicooncología. 2006;2:183-96.
Algunos artículos similares:
- Nancy Gélvez, Johana Acosta, Greizy López, Derly Castro, Juan Carlos Prieto, Martha Bermúdez, Marta L. Tamayo, Caracterización fenotípica y molecular de una familia colombiana con fenilcetonuria , Biomédica: Vol. 36 Núm. 3 (2016)
- Amanda Maestre, Jaime Carmona-Fonseca, Amanda Maestre, Alta frecuencia de mutaciones puntuales en pfcrt de Plasmodium falciparum y emergencia de nuevos haplotipos mutantes en Colombia , Biomédica: Vol. 28 Núm. 4 (2008)
- Óscar Gamboa, Sandra Díaz, Liliana Chicaíza, Mario García, Análisis de costo-efectividad en Colombia de anastrazol Vs. tamoxifeno como terapia inicial en mujeres con cáncer temprano de mama y receptor hormonal positivo , Biomédica: Vol. 30 Núm. 1 (2010)
- John Alexander Galindo, Fabio Aníbal Cristiano, Angélica Knudson, Rubén Santiago Nicholls, Ángela Patricia Guerra, Mutaciones puntuales en los genes dhfr y dhps de Plasmodium falciparum de tres regiones endémicas , Biomédica: Vol. 30 Núm. 1 (2010)
- Juan Carlos Herrera, Luis Fernando Isaza, José Luis Ramírez, Gonzalo Vásquez, Carlos Mario Muñetón, Detección de aneuploidías del cromosoma 17 y deleción del gen TP53 en una amplia variedad de tumores sólidos mediante hibridación in situ fluorescente bicolor , Biomédica: Vol. 30 Núm. 3 (2010)
- Wilson Mejía, Carlos Castro, Adriana Umaña, Clemencia de Castro, Tulia Riveros, Myriam Sánchez-Gómez, Señalización asociada al receptor del factor de crecimiento similar a la insulina de tipo I en una línea celular colombiana de carcinoma mamario , Biomédica: Vol. 30 Núm. 4 (2010)
- Gabriel Bedoya, Jenny García, Patricia Montoya, Winston Rojas, Maria Eugenia Amézquita, Iván Soto, Maria Cecilia López, Jorge Ospina-Duque, Andrés Ruiz-Linares, Análisis de isonimia entre poblaciones del noroeste de Colombia , Biomédica: Vol. 26 Núm. 4 (2006)
- Luis Caraballo, Josefina Zakzuk, Consideraciones sobre la evolución de la respuesta inmunitaria Th2 y sus posibles relaciones con parasitosis y alergia , Biomédica: Vol. 32 Núm. 1 (2012)
- Diana Sanabria, Helena Groot, Julio Guzmán, María Claudia Lattig, Una mirada al albinismo óculo-cutáneo: reporte de mutaciones en el gen TYR en cinco individuos colombianos , Biomédica: Vol. 32 Núm. 2 (2012)
- Martha Lucía Serrano, Juan José Yunis, Identificación de tres nuevas mutaciones en el gen RB1 en pacientes con retinoblastoma esporádico en Colombia , Biomédica: Vol. 33 Núm. 1 (2013)
| Estadísticas de artículo | |
|---|---|
| Vistas de resúmenes | |
| Vistas de PDF | |
| Descargas de PDF | |
| Vistas de HTML | |
| Otras vistas | |

























