Prevalencia de Borrelia burgdorferi sensu lato en roedores sinantrópicos de dos comunidades rurales de Yucatán, México
Resumen
Introducción. La enfermedad de Lyme es una zoonosis multisistémica causada por Borrelia burgdorferi sensu lato. Esta espiroqueta circula en un ciclo enzoótico entre un reservorio vertebrado primario y las garrapatas. Se ha encontrado que varias especies de roedores son eficientes reservorios naturales de B. burgdorferi s.l.
Objetivo. Estimar la prevalencia de B. burgdorferi s.l. en roedores sinantrópicos en dos comunidades rurales de Yucatán, México.
Materiales y métodos. Se capturaron 123 roedores (94 Mus musculus y 29 Rattus rattus) para obtener muestras de tejidos de oreja y vejiga. Para la detección de B. burgdorferi s.l. en las muestras, se amplificaron los genes de la flagelina B (fla B) y las lipoproteínas de membrana externa, ospC y p66, mediante reacción en cadena de la polimerasa, y se secuenciaron los amplicones obtenidos.
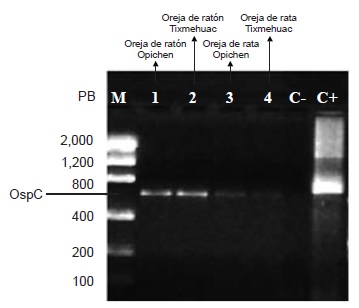
Resultados. La frecuencia de infección por B. burgdorferi s.l. en roedores fue de 36,5 % para flaB (45/123), de 10,5 % (13/123) para p66 y de 3,2 % (4/123) para ospC. En R. rattus la frecuencia de infección fue de 17,2 % y en M. musculus fue de 42,5 %. La frecuencia de infección de B. burgdorferi s.l. en los tejidos estudiados fue de 11,3 % (14/123) en muestras de tejido de vejiga y de 17,0 % (21/123) en las de oreja. No se encontraron diferencias estadísticas (p>0,05) en la frecuencia de infección entre los dos tipos de muestras de tejido utilizadas para el diagnóstico. El gen ospC presentó 98 % de homología con la especie Borrelia garinii, una de las especies heterogéneas del complejo B. burgdorferi s.l.
Conclusiones. Los roedores presentaron una alta prevalencia de infección con B. burgdorferi s.l.; las especies M. musculus y R. rattus podrían jugar un papel importante en la continuidad de la presencia de esta bacteria en comunidades rurales de Yucatán, México.
Descargas
Referencias bibliográficas
Centers for Disease Control and Prevention. Lyme disease - 2015. Fecha de consulta: 22 de enero de 2015. Disponible en: www.cdc.gov/lyme.
Feria TP, Castro I, Gordillo G, Cavazos AL, Vargas M, Grover A, et al. Implications of climate change on the distribution of the tick vector Ixodes scapularis and risk for Lyme disease in the Texas-Mexico transboundary region. Parasit Vect. 2014;7:199. http://dx.doi.org/10.1186/1756-3305-7-199.
Guzmán C, Robbins RG, Pérez TM. The Ixodes (Acari: Ixodidae) of Mexico: Parasite-host and host-parasite checklists. Zootaxa. 2007;1553:47-58.
Illoldi P, Rivaldi CL, Sissel B, Trout-Fryxell R, Gordillo-Pérez G, Rodríguez-Moreno A, et al. Species distribution models and ecological suitability analysis for potential tick vectors of Lyme disease in México. J Trop Med. 2012;2012:10. http://dx.doi.org/10.1155/2012/959101.
Martínez A, Salinas A, Martínez F, Cantu A, Miller DK. Serosurvey for selected disease agents in white-tailed deer from México. J Wildl Dis. 1999;35:799-803. http://dx.doi.org/10.7589/0090-3558-35.4.799.
Tinoco L, Quiroz H, Quintero MT, Rentería-Evangelista TM, Barreras-Serrano A, Hori-Oshima, S, et al. Prevalence and risk factors for Borrelia burgdorferi infection in Mexicali, Baja California, a México-US border city. Intern J Appl Res Vet Med. 2008;6:161-5.
Solís A, Rodríguez RI, Barrera MA, Esteve MD, Apanaskevich DA. Ixodes affinis (Acari: Ixodidae) in dogs from rural localities of Yucatán, México: Prevalence, abundance and associated factors. Vet Mex.2015;2:3.
Rodríguez-Vivas RI, Apanaskevich DA, Ojeda-Chi MM, Trinidad-Martínez I, Reyes-Novelo E, Esteve-Gassent MD, et al. Ticks collected from humans, domestic animals, and wildlife in Yucatán, México. Vet Parasitol. 2016.215;103-7. http://dx.doi.org/10.1016/j.vetpar.2015.11.010.
Harrison BA, Rayburn WH Jr, Toliver M, Powell EE, Engber BR, Durden LA, et al. Recent discovery of widespread Ixodes affinis (Acari: Ixodidae) distribution in North Carolina with implications for Lyme disease studies. J Vector Ecol. 2010;35:174-9. http://dx.doi.org/10.1111/j.1948-7134.2010.00044.x.
Gordillo G, Torres J, Solórzano F, de Martino S, Lipsker D, Velázquez E, et al. Borrelia burgdorferi infection and cutaneous Lyme disease, México. Emerg Infect Dis. 2007; 13:1556-8. http://dx.doi.org/10.3201/eid1310.060630.
Gordillo G, Solórzano F. Enfermedad de Lyme. Experiencia en niños mexicanos. Bol Med Hosp Infant Mex. 2010; 67:164-76.
Lane RS, Brown RN. Wood rats and kangaroo rats: Potential reservoirs of the Lyme disease spirochete in California. J Med Entomol. 1991;28:299-302.
Minnelli A, Bertolotti L, Gern L, Gray J. Ecology of Borrelia burgdorferi sensu lato in Europe: Transmission dynamics in multi-host systems, influence of molecular processes and effects of climate change. FEMS Microbiol Vet. 2012;36:837-61. http://dx.doi.org/10.1111/j.1574-6976.2011.00312.x.
Gern L, Siegenthaler M, Hu CM, Leuba-García S, Humair PF, Moret J. Borrelia burgdorferi in rodents (Apodemus flavicollis and A. sylvaticus): Duration and enhancement of infectivity for Ixodes ricinus ticks. Eur J Epidemiol. 1994;10:75-80.
Petney TN, Hassler D, Brückner M, Mailwad M. Comparison of urinary bladder and ear biopsy samples for determining prevalence of Borrelia burgdorferi in rodents in central Europe. J Clin Microbiol. 1996;34:1310-2.
Levi T, Kilpatrick AM, Mangel M, Wilmers C. Deer, predators, and the emergence of Lyme disease. Proc Natl Acad Sci USA. 2012;109:10942-7. http://dx.doi.org/10.1073/pnas.1204536109.
Stevenson HL, Bai Y, Kosoy MY, Montenieri JA, Lowell JL, Chu MC, et al. Detection of novel Bartonella strains and Yersinia pestis in prairie dogs and their fleas (Siphonaptera: Ceratophyllidae and Pulicidae) using multiplex polymerase chain reaction. J Med Entomol. 2003;40:329-37. http://dx.doi.org/10.1603/0022-2585-40.3.329.
Durden LA, Polur RN, Nims T, Banks CW, Oliver JH Jr. Ectoparasites and other epifaunistic arthropods of sympatric cotton mice and golden mice: Comparisons and implications for vector-borne zoonotic diseases. J Parasitol. 2004;90:1293-7. http://dx.doi.org/10.1645/GE-333R.
Mihalca AD, Dumitrache MO, Sándor AD, Magdaş C, Oltean M, Györke A, et al. Tick parasites of rodents in Romania: Host preferences, community structure and geographical distribution. Parasit Vectors. 2012;5:266. http://dx.doi.org/10.1186/1756-3305-5-266.
Bhide M, Travnicek M, Curlik J, Stefancikova A. The importance of dogs in eco-epidemiology of Lyme borreliosis: A review. Vet Med. 2004;4:135-42.
Richter D, Schlee DB, Matuschka FR. Reservoir competence of various rodents for the Lyme disease spirochete Borrelia spielmanii. Appl Environ Microbiol. 2011;77:3565-70. http://dx.doi.org/10.1128/AEM.00022-11.
Instituto Nacional de Estadística y Geografía. Censo General de Población y Vivienda, 2010-2015. Fecha de consulta: 3 de marzo de 2015. Disponible en: http://www.inegi.org.mx/est/contenidos/proyectos/ccpv/.
Sikes RS, Gannon WL, Animal Care and Use Committee of the American Society of Mammalogists. Guidelines of the American Society of Mammalogists for the use of wild mammals in research. J Mammal. 2011;92:235-53.
Reid FA, FieldA. Guide to the Mammals of Central America & Southeast México. New York: Oxford University Press; 2009.
Goodman J, Jurkovich P, Kodner C, Johnson RC. Persistent cardiac and urinary tract infections with Borrelia burgdorferi in experimentally infected Syrian hamsters. J Clin Microbiol. 1991;29:894-6.
Jaulhac B, Heller R, Limbach FX, Hansmann Y, Lipsker D, Monteil H, et al. Direct molecular typing of Borrelia burgdorferi sensu lato species in synovial samples from patients with Lyme arthritis. J Clin Microbiol. 2000;38: 1895-900.
Bunikis J, Tsao J, Luke CJ, Luna MG, Fish D, Barbour AG. Borrelia burgdorferi infection in a natural population of Peromyscus leucopus mice: A longitudinal study in an area where Lyme Borreliosis is highly endemic. J Infect Dis. 2004;189:1515-23. http://dx.doi.org/10.1086/382594.
Bunikis J, Garpmo U, Tsao J, Berglund J, Fish D, Barbour AG. Sequence typing reveals extensive strain diversity of the Lyme borreliosis agents Borrelia burgdorferi in North America and Borrelia afzelii in Europe. Microbiology. 2004;150:1741-55. http://dx.doi.org/10.1099/mic.0.26944-0.
Oliveira A, Menezes F, Barbosa Sousa J, Madi RR, Melo CM. Parasitic and fungal infections in synanthropic rodents in an area of urban expansion, Aracaju, Sergipe State, Brazil. Acta Sci Biol Sci. 2014;36:113-20. http://dx.doi.org/10.4025/actascibiolsci.v36i1.19760.
Hornok S, Földvári G, Rigó K, Meli ML, Gönczi E, Répási A, et al. Synanthropic rodents and their ectoparasites as carriers of a novel haemoplasma and vector-borne, zoonotic pathogens indoors. Parasit Vectors. 2015;8:27. http://dx.doi.org/10.1186/s13071-014-0630-3.
Hou X, Xu J, Hao Q, Xu G, Geng Z, Zhang L. Prevalence of Borrelia burgdorferi sensu lato in rodents from Jiangxi, southeastern China region. Int J Clin Exp Med. 2014;7:5563-7.
Allan B, Keesing F, Ostfeld RS. Effect of forest fragmentation on Lyme disease risk. Conserv Biol. 2003;17:267-72.
Manzano R, Díaz V, Pérez R. Garrapatas: características anatómicas, epidemiológicas y ciclo vital. Detalles de la influencia de las garrapatas sobre la producción y sanidad animal. Parasitología Animal. Salamanca: Instituto de Recursos Naturales y Agrobiología de Salamanca; 2012. p. 1-8.
Anderson JF, Johnson RC, Magnarelli LA. Seasonal prevalence of Borrelia burgdorferi in natural populations of white-footed mice, Peromyscus leucopus. J Clin Microbiol. 1987;25:1564-6.
Burgess EC, Wachal MD, Cleven TD. Borrelia burgdorferi infection in dairy cows, rodents, and birds from four Wisconsin dairy farms. Vet Microbiol. 1993;35:61-77. http://dx.doi.org/10.1016/0378-1135(93)90116-O.
Humair PF, Peter O, Wallich R, Gern L. Strain variation of Lyme disease spirochetes isolated from Ixodes ricinus ticks and rodents collected in two endemic areas in Switzerland. J Med Entomol. 1995;32:433-8. http://dx.doi.org/10.1093/jmedent/32.4.433.
Escudero R, Barral M, Pérez A, Vitutia MM, García-Pérez AL, Jiménez S, et al. Molecular and pathogenic characterization of Borrelia burgdorferi sensu lato isolates from Spain. J Clin Microbiol. 2000;38:4026-33.
Radzijevskaja J, Paulauskas A, Rosef O. Molecular detection and characterization of Borrelia burgdorferi sensu lato in small rodents. Vet Med Zoot. 2011;55:40-6.
Smith RP Jr, Muzaffar SB, Lavers J, Lacombe EH, Cahill BK, Lubelczyk CB, et al. Borrelia garinii in seabird ticks (Ixodes uriae), Atlantic Coast, North America. Emerg Infect Dis. 2006;12:1909-12. http://dx.doi.org/10.3201/eid1212.060448.
Rudenko N, Golovchenko M, Hönig V, Mallátová N, Krbková L, Mikulášek P, et al. Detection of Borrelia burgdorferi sensu stricto ospC alleles associated with human Lyme borreliosis worldwide in non-human-biting tick Ixodes affinis and rodent hosts in southeastern United States. Appl Environ Microbiol. 2013;1444-53. http://dx.doi.org/10.1128/AEM.02749-12.
Qiu WG, Bruno JF, McCaig WD, Xu Y, Livey I, Schriefer ME, et al. Wide distribution of a high-virulence Borrelia burgdorferi clone in Europe and North America. Emerg Infect Dis. 2008;14:1097-104. http://dx.doi.org/10.3201/eid1407.070880.
Olsen B, Munster VJ, Wallensten A, Waldenstrom J, Osterhaus AD, Fouchier RA. Global patterns of influenza a virus in wild birds. Science. 2006;312:384-8. http://dx.doi.org/10.1126/science.1122438.
Comstedt P, Jakobsson T, Bergström S. Global ecology and epidemiology of Borrelia garinii spirochetes. Infect Ecol Epidemiol. 2011;1:10. http://dx.doi.org/10.3402/iee.v1i0.9545.
Scott JD, Durden LA, Anderson JF. Infection prevalence of Borrelia burgdorferi in ticks collected from songbirds in Far-Western Canada. Open J Anim Sci. 2015;5:232-41. http://dx.doi.org/10.4236/ojas.2015.53027.
Steere AC, Coburn J, Glickstein L. The emergence of Lyme disease. J Clin Invest. 2004;113:1093-101. http://dx.doi.org/10.1172/JCI21681.
Will G, Jauris S, Schwab E, Busch U, Rössler D, SoutschekE, et al. Sequence analysis of OspA genes shows homogeneity within Borrelia burgdorferi sensu stricto and Borrelia afzelii strains but reveals major subgroups within the Borrelia gariniis pecies. Med Microbiol Immunol. 1995;184:73-80.
Kurtenbach K, De Michelis S, Sewell HS, Etti S, Schäfer SM, Holmes E, et al. The key roles of selection and migration in the ecology of Lyme borreliosis. Int J Med Microbiol. 2002;33:152-4. http://dx.doi.org/10.1016/S1438-4221(02)80029-7.
Rudenko N, Golovchenco M, Belfiore NM, Grubhoffer L, Oliver JH Jr. Divergence of Borrelia burgdorferi sensu lato spirochetes could be driven by the host: Diversity of Borrelia strains isolated from ticks feeding on a single bird. Parasit Vectors. 2014;7:4. http://dx.doi.org/10.1186/1756-3305-7-4 .
Algunos artículos similares:
- José Alejandro Martínez-Ibarra, Jorge Alejandro Martínez-Grant, Miguel Roberto Verdugo-Cervantes, Rafael Bustos-Saldaña, Benjamín Nogueda-Torres, Vigilancia de la presencia de triatominos mediante gallineros en el sur de Jalisco, México , Biomédica: Vol. 30 Núm. 1 (2010)
- Gladys Acuña-González, Carlo E. Medina-Solís, Gerardo Maupomé, Mauricio Escoffie-Ramírez, Jesús Hernández-Romano, María de L. Márquez-Corona, Arturo J. Islas-Márquez, Juan J. Villalobos-Rodelo, Factores de riesgo hereditarios y socioeconómicos para labio o paladar hendido no asociados a un síndrome en México: estudio de casos y controles pareado , Biomédica: Vol. 31 Núm. 3 (2011)
- Juan José Villalobos Rodelo, Carlo Eduardo Medina Solís, Nelly Molina Frechero, Ana Alicia Vallejos Sánchez, América Patricia Pontigo Loyola, José Luis Espinoza Beltrán, Caries dental en escolares de 6 a 12 añios de edad en Navolato, Sinaloa, México: experiencia, prevalencia, gravedad y necesidades de tratamiento. , Biomédica: Vol. 26 Núm. 2 (2006)
- Eduardo Rodríguez-Noriega, Gerardo León-Garnica, Santiago Petersen-Morfín, Héctor Raúl Pérez-Gómez, Esteban González-Díaz, Rayo Morfín-Otero, La evolución de la resistencia bacteriana en México, 1973-2013 , Biomédica: Vol. 34 (2014): Abril, Suplemento 1, Resistencia bacteriana
- Zinnia J. Molina-Garza, Lucio Galaviz-Silva, Pediculus capitis en niños de escuelas de la zona urbana de Nuevo León, México: análisis de factores asociados , Biomédica: Vol. 37 Núm. 3 (2017)
- Eduardo Bustos-Vázquez, Julián Alfredo Fernández-Niño, Claudia Iveth Astudillo-Garcia, Autopercepción de la salud, presencia de comorbilidades y depresión en adultos mayores mexicanos: propuesta y validación de un marco conceptual simple , Biomédica: Vol. 37 Núm. Sup.1 (2017): Suplemento 1, Alteraciones del sistema nervioso
- Claudio Alberto Dávila, Ana Melisa Pardo, Mortalidad por suicidios en Colombia y México: tendencias e impacto entre 2000 y 2013 , Biomédica: Vol. 36 Núm. 3 (2016)
- Lizbeth Díaz, Karen Covarrubias, Ángel Licón, Mixtli Astorga, Yaneth Moreno, José Alejandro Martínez, Parámetros biológicos de Meccus phyllosomus phyllosomus (Burmeister) 1835, de Triatoma recurva (Stål) 1868 (Hemiptera, Reduviidae) y de sus híbridos de laboratorio , Biomédica: Vol. 37 Núm. Sup. 2 (2017): Suplemento 2, Entomología médica, 2017
- Jesús Delgado-De la Mora, Jesús David Licona-Enríquez, Marcia Leyva-Gastélum, David Delgado-De la Mora, Adela Rascón-Alcantar, Gerardo Álvarez-Hernández, Una serie de casos fatales de fiebre manchada de las Montañas Rocosas en Sonora, México , Biomédica: Vol. 38 Núm. 1 (2018)
- Mayra L. Lúa, Arturo Plascencia, Patricia Paredes, Yaxsier de Armas, Miguel Raygoza, Erika Martínez, Fernando Siller, Iván Isidro Hernández, Identificación etiológica de agentes virales de la encefalitis aguda en Guadalajara, México, 2011-2015 , Biomédica: Vol. 38 Núm. 2 (2018)
| Estadísticas de artículo | |
|---|---|
| Vistas de resúmenes | |
| Vistas de PDF | |
| Descargas de PDF | |
| Vistas de HTML | |
| Otras vistas | |

























