Arsenotoxicidad aguda experimental en ratones Balb/c: marcadores orgánicos y compromiso esplénico
Resumen
Introducción. El arsénico es un tóxico ambiental ampliamente diseminado en todo el mundo. En hombres y animales, diversos órganos y tejidos son blancos de sus efectos deletéreos, entre ellos, el los del sistema inmunológico.
Objetivo. Determinar la intoxicación aguda por arsénico en tejidos y células diana de ratones Balb/c in vivo.
Materiales y métodos. Se aplicó una inyección intraperitoneal de 9,5 o 19 mg/kg de arsenito de sodio (NaAsO2) o un volumen equivalente de solución fisiológica como control, en ratones Balb/c con 3 por cada grupo experimental. Tras media hora, los animales fueron sacrificados y se extrajeron bazos, timos, hígados, riñones y sangre. En cada muestra, se determinó la concentración de arsénico, polifenoles y hierro, y también, se evaluaron marcadores oxidativos, como peróxidos, productos avanzados de oxidación proteica y grupos sulfhidrilos libres. En los esplenocitos obtenidos del bazo, se determinaron la viabilidad celular y el potencial mitocondrial.
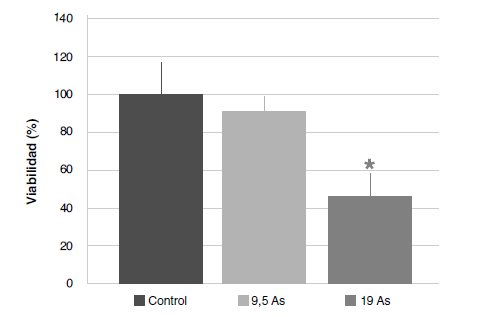
Resultados. La dosis aguda inyectada de NaAsO2 redujo la función mitocondrial de los esplenocitos, lo que derivó en muerte celular. La presencia confirmada de arsénico en las muestras de bazo y la citotoxicidad resultante, produjeron disminución de los polifenoles y de los grupos sulfhidrilos libres, y alteraron el contenido y la distribución del hierro, pero no se aumentó la producción de peróxidos.
Conclusión. Estos hallazgos aportan evidencia científica sobre los cambios en biomarcadores involucrados en la inmunotoxicidad del arsénico y ofrecen, además, una metodología para ensayar potenciales tratamientos frente a la acción deletérea de este compuesto en el sistema inmunológico.
Descargas
Referencias bibliográficas
Grinyó JM, Cruzado JM, Bestard O, Vidal-Castañeira JR, Torras J. Immunosuppression in the era of biological agents. Adv Exp Med Biol. 2012;741:60-72. https://doi.org/10.1007/978-1-4614-2098-9_5
Ferrario D, Gribaldo L, Hartung T. Arsenic eExposure and immunotoxicity: A review including the possible influence of age and sex. Curr Environ Health Rep. 2016;3:1-12. https://doi.org/10.1007/s40572-016-0082-3
Cordero H, Morcillo P, Martínez S, Meseguer J, Pérez-Sirvent C, Chaves-Pozo E, et al. Inorganic arsenic causes apoptosis cell death and immunotoxicity on European sea bass (Dicentrarchus labrax). Mar Pollut Bull. 2018;128:324-32. https://doi.org/10.1016/j.marpolbul.2018.01.052
Hughes MF, Beck BD, Chen Y. Arsenic exposure and toxicology: A historical perspective. Toxicol Sci. 2011;123:305-32. https://doi.org/10.1093/toxsci/kfr184
Acharya S, Chaudhuri S, Chatterjee S, Kumar P, Begum Z, Dasgupta S, et al. Immunological profile of arsenic toxicity: A hint towards arsenic-induced carcinogenesis. Asian Pac J Cancer Prev. 2010;11:479-90.
Ng JC. Environmental contamination of arsenic and its toxicological impact on humans. Environ Chem. 2005;2:146-60. https://doi.org/10.1071/EN05062
Miranda AR, Soria EA. Análisis proteasomal y multidimensional en quimioencefalopatía aguda inducida por arsénico trivalente en ratones y neuroprotección por ácido clorogénico. En: INC. Becas de investigación en cáncer 2015-2016: Informes finales de estudiantes avanzados y graduados. Primera edición. Ciudad Autónoma de Buenos Aires: Instituto Nacional del Cáncer; 2017. p. 73-84.
Pérez RD, Falchini GE, Cometto-Vincente F, Soares L, Poletti ME, Sánchez HJ. A new spectrometer using a crystal monochromator and parallel plates beam guides. Nuc Istr Meth. 2019;440:48-53. https://doi.org/10.1016/j.nimb.2018.11.030
Chen JL, Steele TWJ, Stuckey DC. Metabolic reduction of resazurin; location within the cell for cytotoxicity assays. Biotechnol Bioeng. 2018;115:351-8. https://doi.org/10.1002/bit.26475
Ait Baddi G, Cegarra J, Merlina G, Revel JC, Hafidi M. Qualitative and quantitative evolution of polyphenolic compounds during composting of an olive-mill waste-wheat straw mixture. J Hazard Mater. 2009;165:1119-23. https://doi.org/10.1016/j.jhazmat.2008.10.102
Pieroni G, Khalil L, Charlotte F, Poynard T, Piton A, Hainque B, et al. Comparison of bathophenanthroline sulfonate and ferene as chromogens in colorimetric measurement of low hepatic iron concentration. Clin Chem. 2001;47:2059-61.
Soria EA, Goleniowski ME, Cantero JJ, Bongiovanni GA. Antioxidant activity of different extracts of Argentinian medicinal plants against arsenic-induced toxicity in renal cells. Hum Exp Toxicol. 2008;27:341-6. https://doi.org/10.1177/0960327108092192
Piwowar A. Advanced oxidation protein products. Part I. Mechanism of the formation, characteristics and property. Pol Merkur Lekarski. 2010;28:166-9.
InfoStat. InfoStat versión 2018. Córdoba: Universidad Nacional de Córdoba; 2018.
Rubatto-Birri PN, Pérez RD, Cremonezzi D, Pérez CA, Rubio M, Bongiovanni GA. Association between As an Cu renal cortex accumulation and physiological and histological alterations after chronic arsenic intake. Environ Res. 2010;110:417-23. https://doi.org/10.1016/j.envres.2009.09.002
Soria EA, Pérez RD, Queralt I, Pérez CA, Bongiovanni GA. Immunotoxicological effects of arsenic bioaccumulation on spatial metallomics and cellular enzyme response in the spleen of male Wistar rats after oral intake. Toxicol Lett. 2017;266:65-73. https://doi.org/10.1016/j.toxlet.2016.12.014
Patra PH, Bandyopadhyay S, Bandyopadhyay MC, Mandal TK. Immunotoxic and genotoxic potential of arsenic and its chemical species in goats. Toxicol Int. 2013;20:6-10. https://doi.org/10.4103/0971-6580.111533
D´Archivio M, Filesi C, Varí R, Scazzocchio B, Masella R. Bioavailability of the polyphenols: Status and controversias. Int J Mol Sci. 2010;11:1321-42. https://doi.org/10.3390/ijms11041321
Mahmud H, Fӧller M, Lang F. Arsenic-induced suicidal erythrocyte death. Arch Toxicol. 2009;83:107-13. https://doi.org/10.1007/s00204-008-0338-2
Wang L, Xu ZR, Jia XY, Han XY. Effects of dietary arsenic levels on serum parameters and trace mineral retentions in growing and finishing pigs. Biol Trace Elem. 2006;113:155-64. https://doi.org/10.1385/BTER:113:2:155
Cui X, Okayasu R. Arsenic accumulation, elimination and interaction with copper, zinc and manganese in liver and kidney of rats. Food Chem Toxicol. 2008;46:3646-50. https://doi.org/10.1016/j.fct.2008.09.040
Montelescaut E, Vermeersch V, Commandeur D, Huynh S, Danguy des Deserts M, Sapin J, et al. Acute arsenic poisoning. Ann Biol Clin (Paris). 2014;72:735-8. https://doi.org/10.1684/abc.2014.1012
Watanabe T, Hirano S. Metabolism of arsenic and its toxicological relevance. Arch Toxicol. 2013;87:969-79. https://doi.org/10.1007/s00204-012-0904-5
Xu H, Medina S, Lauer FT, Douillet C, Liu KJ, Stýblo M, et al. Genotoxicity induced by monomethylarsonous acid (MMA+3) in mouse thymic developing T cells. Toxicol Lett. 2017;279:60-6. https://doi.org/10.1016/j.toxlet.2017.07.897
Xu H, McClain S, Medina S, Lauer FT, Douillet C, Liu KJ, et al. Differential sensitivities of bone marrow, spleen and thymus to genotoxicity induced by environmentally relevant concentrations of arsenite. Toxicol Lett. 2016;262:55-61. https://doi.org/10.1016/j.toxlet.2016.09.008
Zhou X, Sun X, Mobarak C, Gandolfi AJ, Burchiel SW, Hudson LG, et al. Differential binding of monomethylarsonous acid compared to arsenite and arsenic trioxide with zinc finger peptides and proteins. Chem Res Toxicol. 2014;27:690-8. https://doi.org/10.1021/tx500022j
Pelicano H, Feng, L, Zhou Y, Carew JS, Hileman EO, Plunkett W, et al. Inhibition of mitochondrial respiration: A novel strategy to enhance drug-induced apoptosis in human leukemia cells by a reactive oxygen species-mediated mechanism. J Biol Chem. 2003;278:37832-9. https://doi.org/10.1074/jbc.M301546200
Belzacq AS, El Hamel C, Vieira HL, Cohen I, Haouzi D, Metivier D, et al. Adenine nucleotide translocator mediates the mitochondrial membrane permeabilization induced by lonidamine, arsenite and CD437. Oncogene. 2001;20:7579-87. https://doi.org/10.1038/sj.onc.1204953
Skulachev VP. Bioenergetic aspects of apoptosis, necrosis and mitoptosis. Apoptosis. 2006;11:473-85. https://doi.org/10.1007/s10495-006-5881-9
Moe B, Peng H, Lu X, Chen B, Chen L, Gabos S, et al. Comparative cytotoxicity of fourteen trivalent and pentavalent arsenic species determined using real-time cell sensing. J Environ Sci (China). 2016;49:113-24. https://doi.org/10.1016/j.jes.2016.10.004
Rahman MT, De Ley M. Arsenic induction of metallothionein and metallothionein induction against arsenic cytotoxicity. Rev Environ Contam Toxicol. 2017;240:151-68. https://doi.org/10.1007/398_2016_2
Algunos artículos similares:
- Edisson Rodríguez, Aura María Gil-Villa, Daniel Camilo Aguirre-Acevedo, Walter Cardona-Maya, Ángela P. Cadavid, Evaluación de parámetros seminales no convencionales en individuos cuyas parejas presentan muerte embrionaria temprana recurrente: en busca de un valor de referencia , Biomédica: Vol. 31 Núm. 1 (2011)
- Andrés F. Londoño, Silvana Levis, Juan D. Rodas, Hantavirus como agentes emergentes de importancia en Suramérica , Biomédica: Vol. 31 Núm. 3 (2011)
- Alvaro Javier Idrovo, Posibles efectos en la salud asociados con la metalurgia precolombina. , Biomédica: Vol. 25 Núm. 3 (2005)
- Jeison Monroy-Gómez, Orlando Torres-Fernández, Distribución de calbindina y parvoalbúmina y efecto del virus de la rabia sobre su expresión en la médula espinal de ratones , Biomédica: Vol. 33 Núm. 4 (2013)
- Anais Castellar, Marco Guevara, Juan D. Rodas, Andrés F. Londoño, Esteban Arroyave, Francisco J. Díaz, Silvana Levis, Pedro J. Blanco, Primera evidencia de infección por el virus de la coriomeningitis linfocítica (arenavirus) en roedores Mus musculus capturados en la zona urbana del municipio de Sincelejo, Sucre, Colombia , Biomédica: Vol. 37 Núm. Sup.1 (2017): Suplemento 1, Alteraciones del sistema nervioso
- Claudia Viviana Barbosa, Carlos Enrique Muskus, Luz Yaneth Orozco, Adriana Pabón, Efecto mutagénico y genotóxico, y expresión de los genes Rad51C, Xiap, P53 y Nrf2 inducidos por extractos antipalúdicos de plantas recolectadas en el Vaupés medio, Colombia , Biomédica: Vol. 37 Núm. 3 (2017)
- Leslie Alejandra Ramírez, Elsy Arlene Pérez-Padilla, Francisco García-Oscos, Humberto Salgado, Marco Atzori, Juan Carlos Pineda, Nueva teoría sobre la depresión: un equilibrio del ánimo entre el sistema nervioso y el inmunológico, con regulación de la serotonina-quinurenina y el eje hipotálamo-hipófiso-suprarrenal , Biomédica: Vol. 38 Núm. 3 (2018)
- Fernando Ucan-Euan, Silvia Hernández-Betancourt, Madeleine Arjona-Torres, Alonso Panti-May, Marco Torres-Castro, Estudio histopatológico de tejido cardiaco de roedores infectados con Trypanosoma cruzi capturados en barrios suburbanos de Mérida, México , Biomédica: Vol. 39 Núm. Supl. 2 (2019): Enfermedades transmisibles en el trópico, agosto
- Manuela Velásquez, Manuel Alejandro Granada, Juan Camilo Galvis, Ángela María Álvarez, Ángela Cadavid, Estrés oxidativo en células endoteliales inducido por el suero de mujeres con diferentes manifestaciones clínicas del síndrome antifosfolípido , Biomédica: Vol. 39 Núm. 4 (2019)
- Juana P. Sánchez-Villamil, Carolina Pino-Vélez, Juanita Trejos-Suárez, Néstor Cardona , Ana Lucía España, Pedro A. Alfonso, Marcadores salivales de estrés oxidativo y agentes patógenos periodontales en pacientes con periodontitis en Santander, Colombia , Biomédica: Vol. 40 Núm. Supl. 1 (2020): Mayo, Infecciones en el trópico
| Estadísticas de artículo | |
|---|---|
| Vistas de resúmenes | |
| Vistas de PDF | |
| Descargas de PDF | |
| Vistas de HTML | |
| Otras vistas | |

























