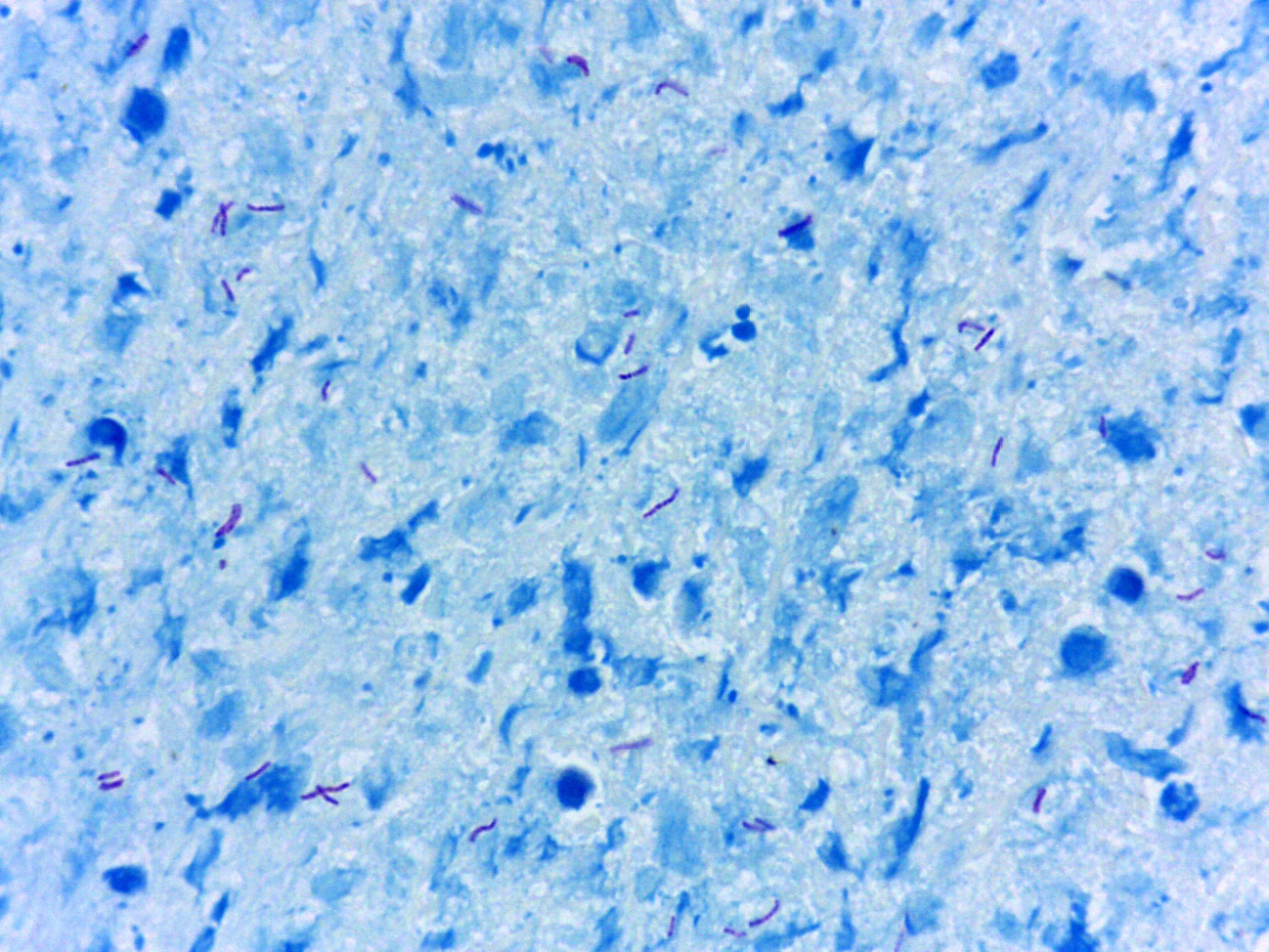
Coloración de Ziehl-Neelsen en el laboratorio de patología: rendimiento y contribución al diagnóstico de micobacterias en el lavado broncoalveolar
Resumen
Introducción. La coloración de Ziehl-Neelsen, con más de 100 años de uso, continúa vigente mundialmente.
Objetivo. Comparar el rendimiento de las pruebas diagnósticas utilizadas para la determinación de micobacterias en el laboratorio clínico de patología en muestras de lavado broncoalveolar.
Materiales y métodos. Se revisaron retrospectivamente 737 muestras de lavado broncoalveolar procesadas en el 2019 y el 2020 en el Hospital San Vicente Fundación (Medellín, Colombia) y se compararon las características de tres pruebas diagnósticas realizadas en paralelo: la reacción en cadena de la polimerasa (PCR) para micobacterias con detección de resistencia, el cultivo, y la coloración de Ziehl-Neelsen.
Resultados. Se catalogaron como enfermos a 93 de los 737 pacientes a partir de los resultados positivos en alguna de las tres pruebas. El cultivo tuvo una sensibilidad de 0,80, la PCR una de 0,76 y la coloración de Ziehl-Neelsen una de 0,51. Sin embargo, solo 5 de 75 (6,5 %) cultivos fueron positivos a las cuatro semanas y el resto lo fue a las ocho semanas. La PCR combinada con la coloración de Ziehl-Neelsen mejoró la sensibilidad de la PCR por sí sola, de 0,76 a 0,88, diferencia que fue estadísticamente significativa (p=0,022).
Conclusión. En las muestras de lavado broncoalveolar, el cultivo sigue siendo la prueba con mejor sensibilidad. El uso conjunto de la prueba de PCR y la coloración de Ziehl-Neelsen mejora significativamente la sensibilidad de la primera, lo que compensa la demora relativa en la entrega de los resultados debida al tiempo requerido para la tinción de Ziehl-Neelsen.
Descargas
Referencias bibliográficas
Khan MK, Islam MN, Ferdous J, Alam MM. An overview on epidemiology of tuberculosis. Mymensingh Med J. 2019;28:259-66.
Pezzella AT. History of pulmonary tuberculosis. Thorac Surg Clin. 2019;29:1-17. https://doi.org/10.1016/j.thorsurg.2018.09.002
Bañuls A-L, Sanou A, van Anh NT, Godreuil S. Mycobacterium tuberculosis: Ecology and evolution of a human bacterium. J Med Microbiol. 2015;64:1261-9. https://doi.org/10.1099/jmm.0.000171
Fadul S. Vigilancia y análisis del riesgo en salud pública, protocolo de vigilancia en salud pública de tuberculosis farmacorresistente. Bogotá, D.C.: Instituto Nacional de Salud; 2019.
Rodríguez-Castillo JG, Llerena C, Argoty-Chamorro L, Guerra J, Couvin D, Rastogi N, et al. Population structure of multidrug-resistant Mycobacterium tuberculosis clinical isolates in Colombia. Tuberculosis (Edinb). 2020;125:102011. https://doi.org/10.1016/j.tube.2020.102011
Santos-Pereira A, Magalhães C, Araújo PMM, S Osório N. Evolutionary genetics of Mycobacterium tuberculosis and HIV-1: “The Tortoise and the Hare.” Microorganisms. 2021;9:147. https://doi.org/10.3390/microorganisms9010147
Gopalaswamy R, Subbian S. Corticosteroids for COVID-19 therapy: potential implications on tuberculosis. Int J Mol Sci. 2021;22:3773. https://doi.org/10.3390/ijms22073773
Anastasopoulou A, Ziogas DC, Samarkos M, Kirkwood JM, Gogas H. Reactivation of tuberculosis in cancer patients following administration of immune checkpoint inhibitors: Current evidence and clinical practice recommendations. J Immunother Cancer. 2019;7:239. https://doi.org/10.1186/s40425-019-0717-7
Naranjo PJ de, Rodríguez G, Rodríguez J, Caldas ML. La coloración de Ziehl-Neelsen en histopatología. Biomédica. 1988;8:84-93. https://doi.org/10.7705/biomedica.v8i3-4.1964
Rincón-Caballero OL, Cano-Romero MA, Aristizábal-Bernal BH. Diagnóstico de tuberculosis pulmonar en lavado broncoalveolar: desempeño de la PCR en comparación con las pruebas microbiológicas de rutina. Med Lab. 2017;23:475-84. https://doi.org/10.36384/01232576.26
Balows A, Hausler WJ Jr, Herrmann KL, Isenberg HD, Shadomy HJ. Manual of Clinical Microbiology. 5th edition. Washington, D.C.: American Society for Microbiology; 1991. p. 1384.
Bodal VK, Bal MS, Bhagat S, Kishan J, Deepika, Brar RK. Fluorescent microscopy and Ziehl-Neelsen staining of bronchoalveolar lavage, bronchial washings, bronchoscopic brushing and post bronchoscopic sputum along with cytological examination in cases of suspected tuberculosis. Indian J Pathol Microbiol. 2015;58:443-7. https://doi.org/10.4103/0377-4929.168849
Elbrolosy AM, El Helbawy RH, Mansour OM, Latif RA. Diagnostic utility of GeneXpert MTB/RIF assay versus conventional methods for diagnosis of pulmonary and extra-pulmonary tuberculosis. BMC Microbiol. 2021;21:144. https://doi.org/10.1186/s12866-021-02210-5
Wasim Yusuf N, Iram S, Zeenat A, Hussain S, Aslam M. Rapid diagnosis of tuberculosis using Xpert MTB/RIF assay - Report from a developing country. Pak J Med Sci. 2015;31:105-10. https://doi.org/10.12669/pjms.311.6970
Zheng L-H, Jia H-Y, Liu X-J, Sun H-S, Du F-J, Pan L-P, et al. Modified cytospin slide microscopy method for rapid diagnosis of smear-negative pulmonary tuberculosis. Int J Tuberc Lung Dis. 2016;20:456-61. https://doi.org/10.5588/ijtld.15.0733
van Deun A, Hamid Salim A, Aung KJM, Hossain MA, Chambugonj N, Hye MA, et al. Performance of variations of carbolfuchsin staining of sputum smears for AFB under field conditions. Int J Tuberc Lung Dis. 2005;9:1127-33.
Tuberculosis Division - International Union Against Tuberculosis and Lung Disease. Tuberculosis bacteriology--priorities and indications in high prevalence countries: Position of the technical staff of the Tuberculosis Division of the International Union Against Tuberculosis and Lung Disease. Int J Tuberc Lung Dis. 2005;9:355-61.
Karstaedt AS, Jones N, Khoosal M, Crewe-Brown HH. The bacteriology of pulmonary tuberculosis in a population with high human immunodeficiency virus seroprevalence. Int J Tuberc Lung Dis. 1998;2:312-6.
Khan EA, Starke JR. Diagnosis of tuberculosis in children: Increased need for better methods. Emerg Infect Dis. 1995;1:115-23. https://doi.org/10.3201/eid0104.950402
Algunos artículos similares:
- Elizabeth Borrero, Gabriel Carrasquilla, Neal Alexander, Descentralización y reforma: ¿cuál es su impacto sobre la incidencia de malaria en los municipios colombianos? , Biomédica: Vol. 32 (2012): Suplemento 1, Malaria
- Nohora Marcela Mendoza, Marisol García, Liliana Jazmín Cortés, Claudia Vela, Rigoberto Erazo, Pilar Pérez, Olga Lucía Ospina, Javier Darío Burgos, Evaluación de dos pruebas rápidas [NOW® ICT Malaria Pf/Pv y OptiMAL®] para el diagnóstico de paludismo en Tumaco, Colombia , Biomédica: Vol. 27 Núm. 4 (2007)
- Raúl Murillo, Ricardo Cendales, Carolina Wiesner, Marion Piñeros, Sandra Tovar, Efectividad de la citología cérvico-uterina para la detección temprana de cáncer de cuello uterino en el marco del sistema de salud de Colombia , Biomédica: Vol. 29 Núm. 3 (2009)
- Sandra Lorena Girón, Julio César Mateus, Fabián Méndez, Impacto de un botadero a cielo abierto en el desarrollo de síntomas respiratorios y en costos familiares de atención en salud de niños entre 1 y 5 años en Cali, Colombia , Biomédica: Vol. 29 Núm. 3 (2009)
- José Joaquín Carvajal, Ligia Inés Moncada, Mauricio Humberto Rodríguez, Ligia del Pilar Pérez, Víctor Alberto Olano, Caracterización preliminar de los sitios de cría de Aedes (Stegomyia) albopictus (Skuse, 1894) (Diptera: Culicidae) en el municipio de Leticia, Amazonas, Colombia , Biomédica: Vol. 29 Núm. 3 (2009)
- Andrés Páez, Gloria Rey, Carlos Agudelo, Alvaro Dulce, Edgar Parra, Hernando Díaz-Granados, Damaris Heredia, Luis Polo, Brote de rabia urbana transmitida por perros en el distrito de Santa Marta, Colombia, 2006-2008 , Biomédica: Vol. 29 Núm. 3 (2009)
- Patricia Escobar, Katherine Paola Luna, Indira Paola Hernández, César Mauricio Rueda, María Magdalena Zorro, Simon L. Croft, Susceptibilidad in vitro a hexadecilfosfocolina (miltefosina), nifurtimox y benznidazole de cepas de Trypanosoma cruzi aisladas en Santander, Colombia , Biomédica: Vol. 29 Núm. 3 (2009)
- Gustavo Pradilla, Julio César Mantilla, Reynaldo Badillo, Encefalitis rábica humana por mordedura de murciélago en un área urbana de Colombia , Biomédica: Vol. 29 Núm. 2 (2009)
- Diana Hoyos , Rossi Meza, Liliana Forero , César Moreira, Beatriz E. Ferro, Robinson Pacheco , Tratamiento para tuberculosis RR/MDR: un análisis comparativo de indicadores programáticos de resultado entre Buenaventura y otros municipios del Valle del Cauca-Colombia , Biomédica: Vol. 44 Núm. 3 (2024): Publicación anticipada, septiembre
- Rosa Magdalena Uscátegui, Adriana M. Correa, Jaime Carmona-Fonseca, Cambios en las concentraciones de retinol, hemoglobina y ferritina en niños palúdicos colombianos , Biomédica: Vol. 29 Núm. 2 (2009)
Derechos de autor 2022 Biomédica

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
Datos de los fondos
| Estadísticas de artículo | |
|---|---|
| Vistas de resúmenes | |
| Vistas de PDF | |
| Descargas de PDF | |
| Vistas de HTML | |
| Otras vistas | |

























