Molecular identification of Leishmania spp. clinical isolates from Colombia based on hsp70 gene
Abstract
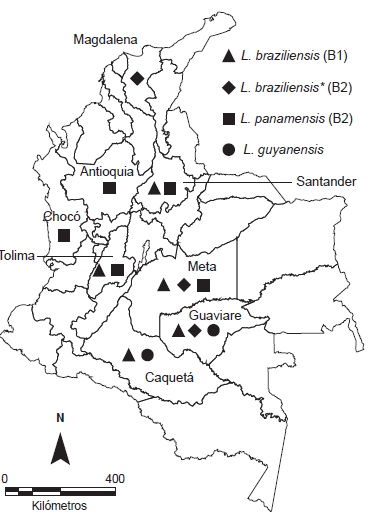
Introduction: Leishmaniasis is highly prevalent in Colombia, where at least six different species can cause disease of varying clinical presentations in humans. The identification of the infecting species is quite important for prognosis, therapeutics and epidemiology. Different techniques with variable discriminatory power have been used for the identification. Objective: To carry out the molecular identification of Leishmania species through the amplification of a fragment of the hsp70 gene. Materials and methods: Molecular amplification of the hsp70 gene fragment (PCR-hsp70) followed by restriction fragment length polymorphism analysis (RFLP) was done for identification purposes using DNA from 81 clinical isolates of Leishmania. Results: A single amplicon was obtained for all samples analyzed. The enzymatic restrictions of the 81 PCR products identified 70 with a banding pattern corresponding to L. braziliensis with two different patterns (62 and eight isolates, respectively), nine isolates compatible with L. panamensis and two with L. guyanensis. The geographical origin of the isolates is consistent with previous reports about the distribution of the corresponding species in Colombia. Conclusions: The PCR-hsp70/RFLP technique used is a valid tool for the identification of Leishmania species isolated from clinical samples of patients in Colombia, which may also be applicable to the study of strains obtained from vectors and reservoirs with epidemiological significance.
Downloads
References
Alvar J, Vélez ID, Bern C, Herrero M, Desjeux P, Cano J, et al. Leishmaniasis worldwide and global estimates of its incidence. PLoS One. 2012;7:e35671. http://dx.doi.org/10.1371/journal.pone.0035671.
Pérez-Ayala A, Norman F, Pérez-Molina JA, Herrero JM, Monge B, López-Vélez R. Imported leishmaniasis: A heterogeneous group of diseases. J Travel Medicine. 2009;16:395-401. http://dx.doi.org/10.1111/j.1708-8305.2009.00341.x.
Handman E, Elso C, Foote S. Genes and susceptibility to leishmaniasis. Adv Parasitol. 2005;59:1-75. http://dx.doi.org/10.1016/S0065-308X(05)59001-8.
Schriefer A,Wilson ME, Carvalho EM. Recent develop-ments leading toward a paradigm switch in the diagnostic and therapeutic approach to human leishmaniasis. Curr Opin Infect Dis. 2008;2:483-8. http://dx.doi.org/10.1097/QCO.0b013e32830d0ee8.
Rivas L, Moreno J, Canavate C, Alvar J. Virulence and disease in leishmaniasis: What is relevant for the patient? Trends Parasitol. 2004; 20:297-301. http://dx.doi.org/10.1016/j.pt.2004.05.005.
Reithinger R, Dujardin JC. Molecular diagnosis of leishmaniasis: Current status and future applications. J Clin Microbiol. 2007;45:21-5. http://dx.doi.org/10.1128/JCM.02029-06.
Schönian G, Kuhls K, Mauricio IL. Molecular approaches for a better understanding of the epidemiology and population genetics of Leishmania. Parasitology. 2011;138:405-23. http://dx.doi.org/10.1017/S0031182010001538.
Cupolillo E, Grimaldi G, Momen H, Beverley SM. Intergenic region typing (IRT): A rapid molecular approach to the characterization and evolution of Leishmania. Mol Biochem Parasitol. 1995;73:145-55.
Volpini AC, Passos VMA, Oliveira GC, Romanha AJ. PCR-RFLP to identify Leishmania (Viannia) braziliensis and L. (Leishmania) amazonensis causing American cutaneous leishmaniasis. Acta Trop. 2004;90:31-7. http://dx.doi.org/10.1016/j.actatropica.2003.10.008.
Ovalle-Bracho C, Porras de Quintana L, Muvdi Arenas S, Ríos-Parra M. Polymerase chain reaction with two molecular targets in mucosal leishmaniasis diagnosis: A validation study. Mem Inst Oswaldo Cruz. 2007;102:549-54. http://dx.doi.org/10.1590/S0074-02762007005000061.
García L, Kindt A, Bermúdez H, Llanos-Cuentas A, De Doncker S, Arévalo J, et al. Culture-independent species typing of neotropical Leishmania for clinical validation of a PCR-based assay targeting heat shock protein 70 genes. J Clin Microbiol. 2004;42:2294-7. http://dx.doi.org/10.1128/JCM.42.5.2294-2297.2004.
Neves-Rocha M, Margonari C, Presot IM, Soares RP. Evaluation of 4 polymerase chain reaction protocols for cultured Leishmania spp. typing. Diagn Microbiol Inf Dis. 2010;68:401-9. http://dx.doi.org/10.1016/j.diagmicrobio.2010.08.007.
Monroy-Ostria M, Nasereddin A, Monteon VM, Guzmán-Bracho C, Jaffe CL. ITS1 PCR-RFLP diagnosis and characterization of Leishmania in clinical samples and strains from cases of human cutaneous leishmaniasis in states of the Mexican Southeast. Interdiscip Persp Inf Dis. 2014;2014:607287. http://dx.doi.org/10.1155/2014/607287.
Buitrago R, Cupolillo E, Bastrenta B, Le Pont F, Martínez E, Barnabé C, et al. PCR-RFLP of ribosomal internal transcribed spacers highlights inter and intra-species variation among Leishmania strains native to La Paz, Bolivia. Inf Gen Evol. 2011;11:557-63. http://dx.doi.org/10.1016/j.meegid.2010.11.019.
Montalvo AM, Fraga J, Monzote L, Montano I, De Doncker S, Dujardin JC, et al. Heat-shock protein 70 PCR-RFLP: A universal simple tool for Leishmania species discrimination in the New and Old World. Parasitology. 2010;137:1159-68. http://dx.doi.org/10.1017/S0031182010000089.
Montalvo AM, Fraga J, Montano I, Monzote L, Marín M, van der Auwera G, et al. Differentiation of Leishmania (Viannia) panamensis and Leishmania (V.) guyanensis using BccI for hsp70 PCR-RFLP. Trans R Soc Trop Med Hyg. 2010; 104:364-7. http://dx.doi.org/10.1016/j.trstmh.2009.12.002.
Corredor A, Kreutzer RD, Tesh RB, Boshell J, Palau MT, Cáceres E, et al. Distribution and ecology of leishmaniasis in Colombia. Am J Trop Med Hyg. 1990;42:206-14.
Martínez LP, Rebollo JA, Luna AL, Cochero S, Bejarano EE. Molecular identification of the parasites causing cutaneous leishmaniasis on the Caribbean coast of Colombia. Parasitol Res. 2010;106:647-52. http://dx.doi.org/10.1007/s00436-009-1712-6.
Urbano J, Sánchez-Moreno M, Ovalle CE, Rosales MJ, Camargo YC, Gutiérrez-Sánchez R, et al. Characterization of cutaneous isolates of Leishmania in Colombia by isoenzyme typing and kDNA restriction analysis. Revista Ibero-Latinoamericana de Parasitología. 2011;70:16-24.
Sambrook J, Fritsch EF, Maniatis T. Molecular cloning. A laboratory manual. 2nd edition. New York: Cold Spring Harbor Laboratory Press; 1989.
Fraga J, Veland N, Montalvo AM, Praet N, Boggild A, Valencia B, et al. Accurate and rapid species typing from cutaneous and mucocutaneous leishmaniasis lesions of the New World. Diagn Microbiol Inf Dis. 2012;74:142-50. http://dx.doi.org/10.1016/j.diagmicrobio.2012.06.010.
Bañuls AL, Hide M, Prugnolle F. Leishmania and the leishmaniases: A parasite genetic update and advances in taxonomy, epidemiology and pathogenicity in humans. Adv Parasitol. 2007;64:1-109. http://dx.doi.org/10.1016/S0065-308X(06)64001-3.
Alves da Silva L, Dos Santos de Sousa C, Cardoso da Graça G, Porrozi L, Cupolillo E. Sequence analysis and PCR-RFLP profiling of the hsp70 gene as a valuable tool for identifying Leishmania species associated with human leishmaniasis in Brazil. Inf Gen Evol. 2010;10:77-83. http://dx.doi.org/10.1016/j.meegid.2009.11.001.
Weigle KA, Dávalos M, Heredia P, Molineros R, Saravia NO, D´Alessandro A. Diagnosis of cutaneous and mucocutaneous leishmaniasis in Colombia: A comparison of seven methods. Am J Trop Med Hyg. 1987;36:489-96.
Ruiz FL, Baquero JE. Leishmaniasis de la mucosa nasal en paciente de 66 años, con 40 años de vivir fuera de área endémica. Reporte de un caso. Acta de Otorrinolaringología y Cirugía de Cabeza y Cuello. 2011;39:39-42.
Odiwuor S, Veland N, Maes I, Arévalo J, Dujardin JC, van der Auwera G. Evolution of the Leishmania braziliensis species complex from amplified fragment length polymorphisms, and clinical implications. Infect Genet Evol. 2012;12:1994-2002. http://dx.doi.org/10.1016/j.meegid.2012.03.028.
Fraga J, Montalvo AM, Maes I, Dujardin JC, van der Auwera G. HindII and SduI digests of heat-shock protein 70 PCR for Leishmania typing. Diagn Microbiol Infect Dis. 2013;77:245-7. http://dx.doi.org/10.1016/j.diagmicrobio.2013.07.023.
Kato H, Calvopiña M, Criollo H, Hashiguchi Y. First human cases of Leishmania (Viannia) naiffi infection in Ecuador and identification of its suspected vector species. Acta Trop. 2013;128:710-3. http://dx.doi.org/10.1016/j.actatropica.2013.09.001.
Rincón MY, Silva SY, Dueñas RE, López-Jaramillo P. Leishmaniasis cutánea diseminada: reporte de dos casos en Santander, Colombia. Rev Salud Pública. 2009;11:145-50. http://dx.doi.org/10.1590/S0124-00642009000100015.
Ovalle CE, Porras L, Rey M, Ríos M, Camargo YC. Distribución geográfica de especies de Leishmania aisladas de pacientes consultantes al Instituto Nacional de Dermatología Federico Lleras Acosta, E.S.E., 1995-2005. Biomédica. 2006;26:145-51. http://dx.doi.org/10.7705/biomedica.v26i1.1508.
Rodríguez-Barraquer I, Góngora R, Prager M, Pacheco R, Montero LM, Nevas A, et al. Etiologic agent of an epidemic of cutaneous leishmaniasis in Tolima, Colombia. Am J Trop Med Hyg. 2008;78:276-82.
Montalvo AM, Fraga J, Maes I, Dujardin JC, van der Auwera G. Three new sensitive and specific heat-shock protein 70 PCRs for global Leishmania species identification. Eur J Clin Microbiol Infect Dis. 2012;31:1453-61. http://dx.doi.org/10.1007/s10096-011-1463-z.
Some similar items:
- Ana Margarita Montalvo, Lianet Monzote, Jorge Fraga, Ivón Montano, Carlos Muskus, Marcel Marín, Simonne De Donck, Iván Darío Vélez, Jean Claude Dujardin, PCR-RFLP and RAPD for typing neotropical Leishmania , Biomedica: Vol. 28 No. 4 (2008)
- Clemencia Ovalle-Bracho, Carolina Camargo, Yira Díaz-Toro, Marcela Parra-Muñoz, Molecular typing of Leishmania (Leishmania) amazonensis and species of the subgenus Viannia associated with cutaneous and mucosal leishmaniasis in Colombia: A concordance study , Biomedica: Vol. 38 No. 1 (2018)
- Iveth J. González, Metacaspases and their role in the life cycle of human protozoan parasites , Biomedica: Vol. 29 No. 3 (2009)
- Marcel Marín, Yudy Alexandra Aguilar, José Robinson Ramírez, Omar Triana, Carlos Enrique Muskus, Molecular and immunological analyses suggest the absence of hydrophilic surface proteins in Leishmania (Viannia) panamensis , Biomedica: Vol. 28 No. 3 (2008)
- Luis Alberto Cortés, Jhon James Fernández, Species of Lutzomyia involved in an urban focus of visceral and cutaneous leishmaniasis , Biomedica: Vol. 28 No. 3 (2008)
- María Teresa Arango, Carlos Jaramillo, María Camila Montealegre, Mabel Helena Bohórquez, María del Pilar Delgado, Genetic characterization of the interleukin 1 β polymorphisms -511, -31 y +3954 in a Colombian population with dyspepsia , Biomedica: Vol. 30 No. 2 (2010)
- Diana Carolina López, Carlos Jaramillo, Felipe Guhl, Population structure and genetic variability of Rhodnius prolixus (Hemiptera: Reduviidae) from different geographic areas of Colombia. , Biomedica: Vol. 27 No. 1esp (2007): Enfermedad de Chagas
- Margaret Paternina-Gómez, Yirys Díaz-Olmos, Luis Enrique Paternina, Eduar Elías Bejarano, High prevalence of infection with Leishmania (Kinetoplastea: Trypanosomatidae) in dogs in northern Colombia , Biomedica: Vol. 33 No. 3 (2013)
- Carlos E. Muskus, Marcel Marín Villa, Metacyclogenesis: a basic process in Leishmania biology , Biomedica: Vol. 22 No. 2 (2002)
- Olga L. Cabrera, Leonard E. Munsterman, Rocío Cárdenas, Reynaldo Gutiérrez, Cristina Ferro, Definition of appropriate temperature and storage conditions in the detection of Leishmania DNA with PCR in phlebotomine flies. , Biomedica: Vol. 22 No. 3 (2002)
| Article metrics | |
|---|---|
| Abstract views | |
| Galley vies | |
| PDF Views | |
| HTML views | |
| Other views | |