Inhibition of defensin A and cecropin A responses to dengue virus 1 infection in Aedes aegypti
Abstract
Introduction: It is essential to determine the interactions between viruses and mosquitoes to diminish dengue viral transmission. These interactions constitute a very complex system of highly regulated pathways known as the innate immune system of the mosquito, which produces antimicrobial peptides that act as effector molecules against bacterial and fungal infections. There is less information about such effects on virus infections.
Objective: To determine the expression of two antimicrobial peptide genes, defensin A and cecropin A, in Aedes aegypti mosquitoes infected with DENV-1.
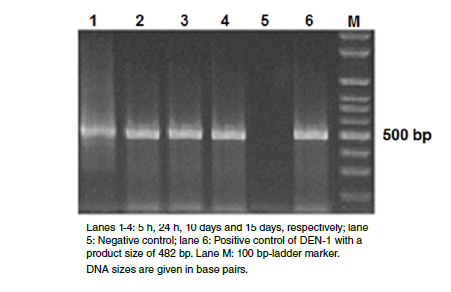
Materials and methods: We used the F1 generation of mosquitoes orally infected with DENV-1 and real-time PCR analysis to determine whether the defensin A and cecropin A genes played a role in controlling DENV-1 replication in Ae. aegypti. As a reference, we conducted similar experiments with the bacteria Escherichia coli.
Results: Basal levels of defensin A and cecropin A mRNA were expressed in uninfected mosquitoes at different times post-blood feeding. The infected mosquitoes experienced reduced expression of these mRNA by at least eightfold when compared to uninfected control mosquitoes at all times post-infection. In contrast with the behavior of DENV-1, results showed that bacterial infection produced up-regulation of defensin and cecropin genes; however, the induction of transcripts occurred at later times (15 days).
Conclusion: DENV-1 virus inhibited the expression of defensin A and cecropin A genes in a wild Ae. aegypti population from Venezuela.
Downloads
References
Ramos-Castañeda J, Barreto dos Santos F, Martínez-Vega R, Galvão de Araujo JM, Joint G, Sarti E. Dengue in Latin America: Systematic review of molecular epidemiological trends. PLoS Negl Trop Dis. 2017;11:e0005224. https://doi.org/10.1371/journal.pntd.0005224
Liu T, Xu Y, Wang X, Gu J, Yan G, Chen XG. Antiviral systems in vector mosquitoes. Dev Comp Immunol. 2018;83:34-43. https://doi.org/10.1016/j.dci.2017.12.025
Sim S, Jupatanakul N, Dimopoulos G. Mosquito immunity against arboviruses. Viruses. 2014;6:4479-504. https://doi.org/10.3390/v6114479
Wang Y, Chang M, Wang X, Zheng AH, Zou Z. The immune strategies of mosquito Aedes aegypti against microbial infection. Dev Comp Immunol. 2018;83:12-21. https://doi.org/10.1016/j.dci.2017.12.001
Blair C. Mosquito RNAi is the major innate immune pathway controlling arbovirus infection and transmission. Future Microbiol. 2011;6:265-77. https://doi.10.2217/fmb.11.11
Carvalho-Leandro D, Ayres C, Guedes D, Suesdek L, Melo-Santos MA, Oliveira CF. Immune transcript variations among Aedes aegypti populations with distinct susceptibility to dengue virus serotype 2. Acta Trop. 2012;124:113-9. https://doi.org/10.1016/j.actatropica.2012.07.006
Mains J, Brelsfoard C, Rose R, Dobson S. Female adult Aedes albopictus suppression by Wolbachia-infected male mosquitoes. Sci Rep. 2016 6:33846. https://doi.org/10.1038/srep33846
Xi Z, Ramírez JL, Dimopoulos G. The Aedes aegypti toll pathway controls dengue virus infection. PLoS Pathog. 2008;4:e1000098. https://doi.org/10.1371/journal.ppat.1000098
Sanders HR, Foy BD, Evans AM, Ross LS, Beaty BJ, Olson KE, et al. Sindbis virus induces transport processes and alters expression of innate immunity pathway genes in the midgut of the disease vector, Aedes aegypti. Insect Biochem Mol Biol. 2005;35:1293-307. https://doi.org/10.1016/j.ibmb.2005.07.006
Luplertlop N, Surasombatpattana P, Patramool S, Dumas E, Wasinpiyamongkol, Saune L, et al. Induction of a peptide with activity against a broad spectrum of pathogens in the Aedes aegypti salivary gland, following infection with dengue virus. PLoS Pathog. 2011;7:e1001252. https://doi.org/10.1371/journal.ppat.1001252
Wasinpiyamongkol L, Missé D, Luplertlop N. Induction of defensin response to dengue infection in Aedes aegypti. Entomol Science. 2015;18:199-206. https://doi.org/10.1111/ens.12108
Pompon J, Manuel M, Ng G, Wong B, Shan C, Manokaran G, et al. Dengue subgenomic flaviviral RNA disrupts immunity in mosquito salivary glands to increase virus transmission. PLoS Pathog. 2017;13:e1006535. https://doi.org/10.1371/journal.ppat.1006535
Mellor PS. Replication of arboviruses in insect vectors. J Comp Path. 2000;123:231-47. https://doi.org/10.1053/jcpa.2000.0434
Urdaneta L, Herrera F, Pernalete M, Zoghbi N, Rubio-Palis Y, Barrios R, et al. Detection of dengue viruses in field-caught Aedes aegypti (Diptera: Culicidae) in Maracay, Aragua state, Venezuela by type-specific polymerase chain reaction. Infect Genet Evol. 2005;5:177-84 https://doi.org/10.1016/j.meegid.2004.09.004
Pfaffl MW. A new mathematical model for relative quantification in real-time RT-PCR. Nucleic Acids Res. 2001;29:2002-7. https://doi.org/10.1093/nar/29.9.e45
Fragkoudis R, Chi Y, Siu R, Barry G, Attarzadeh-Yazdi G, Merits A, et al. Semliki Forest virus strongly reduces mosquito host defense signaling. Insect Mol Biol. 2008;17:647-56. https://doi.org/10.1111/j.1365-2583.2008.00834.x
Colpitts T, Cox J, Vanlandingham D, Feitosa F, Cheng G, Kurscheid S, et al. Alterations in the Aedes aegypti transcriptome during Infection with West Nile, dengue and yellow fever viruses. PLoS Pathog. 2011;7: e1002189. https://doi.org/10.1371/journal.ppat.1002189
Chang-Hyun K, Muturi E. Effect of larval density and Sindbis virus infection on immune responses in Aedes aegypti. J Insect Physiol. 2013;59:604-10. https://doi.org/10.1016/j.jinsphys.2013.03.010
Lin C, Chou C, Hsu Y, Lien J, Wang Y, Chen S, et al. Characterization of two mosquito STATs, AaSTAT and CtSTAT. Differential regulation of tyrosine phosphorylation and DNA binding activity by lipopolysaccharide treatment and by Japanese encephalitis virus infection. J Biol Chem. 2004;279:3308-17. https://doi.org/10.1074/jbc.M309749200
Sim S, Dimopoulos G. Dengue virus inhibits immune responses in Aedes aegypti cells. PLoS One. 2010;5 e10678. https://doi.org/10.1371/journal.pone.0010678
Lambrechts L, Scott T. Mode of transmission and the evolution of arbovirus virulence in mosquito vectors. Proc R Soc B. 2009;276:1369-78. https://doi.org/10.1098/rspb.2008.1709
Cooper D, Chamberlain C, Lowenberger C. Aedes FADD: A novel death domain-containing protein required for antibacterial immunity in the yellow fever mosquito, Aedes aegypti. J Insect Biochem Mol Biol. 2009;39:47-54. https://doi.org/10.1016/j.ibmb.2008.09.011
Bartholomay L, Michel K. Mosquito Immunobiology: the intersection of vector health and vector competence. Annu Rev Entomol. 2018;63:145-67. https://doi.org/10.1146/annurev-ento-010715-023530
Lowenberger C. Innate immune response of Aedes aegypti. Insect Biochem Mol Biol. 2001;31:219-22. https://doi.org/10.1016/s0965-1748(00)00141-7
Some similar items:
- Claudia M.E. Romero, Humberto Llinás, Andrew K.I. Falconar, Evaluation of a rapid water-surface sweeping method to curately estimate numbers of Aedes aegypti (Diptera: Culicidae) late larval stages in large water-storage containers: comparison with pupal estimates , Biomedica: Vol. 30 No. 2 (2010)
- Berlin Londoño-Rentería, Jenny C. Cárdenas, Jeniffer E. Giovanni, Lucio Cárdenas, Paloma Villamizar, Jenniffer Rolón, Daniel M. Chisenhall, Rebecca C. Christofferson, Daysi J. Carvajal, Omar G. Pérez, Dawn M. Wesson, Christopher N. Mores, Aedes aegypti anti-salivary gland antibody concentration and dengue virus exposure history in healthy individuals living in an endemic area in Colombia , Biomedica: Vol. 35 No. 4 (2015)
- Clara Beatriz Ocampo, Camila González, Carlos A. Morales, Mauricio Pérez, Dawn Wesson, Charles S. Apperson, Evaluation of community-based strategies for Aedes aegypti control inside houses , Biomedica: Vol. 29 No. 2 (2009)
- Larry Niño, Use of the function semivariogram and kriging estimation in the spacial analysis of Aedes aegypti (Diptera: Culicidae) distributions , Biomedica: Vol. 28 No. 4 (2008)
- Ronald Maestre, Consuelo Vergara Sanchez, Guillermo Berrueco Rodríguez, Betsy Bello Novoa, Helena Brochero, Presence of Haemagogus equinus Theobald, 1903 (Diptera: Culicidae), in Soledad and Malambo, in the Province of Atlántico, Colombia , Biomedica: Vol. 28 No. 1 (2008)
- Nadia Yadira Castañeda, Jacqueline Chaparro-Olaya, Jaime E. Castellanos, Production and characterization of a polyclonal antibody against rabies virus phosphoprotein , Biomedica: Vol. 27 No. 2 (2007)
- Raquel E. Ocazionez-Jiménez, Ayda Susana Ortiz-Báez, Sergio Yebrail Gómez-Rangel, Daniel R. Miranda-Esquivel, Dengue virus serotype 1 (DENV-1) from Colombia: its contribution to dengue occurrence in Santander , Biomedica: Vol. 33 (2013): Suplemento 1, Fiebres hemorrágicas
- Susanne Ardila-Roldán, Liliana Santacoloma, Helena Brochero, Status of insecticide susceptibility of public health use in natural populations of Aedes aegypti (Diptera: Culicidae) of Casanare, Colombia , Biomedica: Vol. 33 No. 3 (2013)
- César A. Rodriguez, Diana C. Gallego, José A. González, Paola A. Luna, Mitzilene Navarro, Germán A. Ramírez, Mosquitoe breeding sites and fauna ln Armenia's urban area aiier the January 25, 1999, earthquake , Biomedica: Vol. 21 No. 2 (2001)
- Ariosto Ardila, Jesús Escovar, Felio Bello, Characteristics of new cell cultures derived from embryonic tissues of Aedes aegypti (Diptera: Culicidae). , Biomedica: Vol. 25 No. 1 (2005)
| Article metrics | |
|---|---|
| Abstract views | |
| Galley vies | |
| PDF Views | |
| HTML views | |
| Other views | |